Co nebylo v abstraktech
Vyšlo v časopise:
Kardiol Rev Int Med 2005, 7(3): 122-142
L. Berka
Přednáškový blok pracovní skupiny Ambulantních kardiologů na XIII. výročním sjezdu ČKS v Brně dne 9.5.2005 tvořily přednášky dvou našich předních vědeckých i pedagogických odborníků. Následuje pokus o stručný výtah z jejich sdělení:
Spolehlivost a využitelnost publikovaných vědeckých informací pro klinickou praxi – jak vybírat zdroje a vyhnout se omylům
Z. Zadák
Nadbytek i nedostatek informací ztěžuje informaci a zhoršuje kvalitu rozhodování (Norbert Wiener).
Měsíčně vychází na světě 5 000 lékařských časopisů a počet časopisů shrnujících články v jiných časopisech přesahuje 250. V informační oblasti se vytváří mnoho odpadu: Jen 10-15 % publikovaných výsledků prokáže v budoucnosti trvalou vědeckou hodnotu. 40 % publikovaných metod a dat se objeví v literatuře jen jednou. V budoucnosti nikdy nejsou jinými autory potvrzena ani vyvrácena a sám autor ve studiu nepokračuje! Existuje velké množství výzkumných studií, které jen opakují řešení, nebo se nevýznamně liší. Mnoho čtenářů však publikacím nekriticky věří. To jsou jen některé z důvodů, proč je třeba umět informace z literatury vybírat a vědět, jak k těmto informacím přistupovat.
Asi 70 % informací se nachází v 30 % časopisů daného oboru. Přednášející soudí, že chceme-li zachytit hlavní diagnostické trendy, stačí pečlivě sledovat: New England Journal of Medicine; JAMA; Lancet a Cochrane Databáze of Systematic Reviews. Článek, který by neměl ovlivňovat praxi a který je zbytečné číst, rozpoznáme především podle špatně postavené otázky, užívání pochybných metod, nebo metod, které nejsou schopny otázku odpovědět, Prezentované práce nezasluhující, abychom jim věnovali čas, m.j. také např. disponují malým vzorkem, vyvozují nesprávné či neoprávněné závěry. Problém také může působit hodnocení článků firemních, sponzorovaných studií, které mohou prezentovat jen vybrané výsledky.
V závěru sdělení prof. Zadák shrnul kritéria pro výběr hodnotné publikace: prezentace v kvalitním časopise s vysokým impact faktorem. Věnuje péči podrobnému popisu metody (nedostatečný popis metody a dlouhá, nekonkrétní diskuse spolu s pokusy o spekulativní vysvětlení výsledků jsou známkami nekvalitní a málo věrohodné publikace.) Důležité je správné zacházení s daty a jejich statistické vyhodnocení: jsou hodnoceny stanovené cíle, nebo autoři jen hledají signifikantní změny, které pak spekulativně vysvětlují? Konečně je důležitý autorský kolektiv, pracoviště či jiná zaštiťující autorita.
Klady a úskalí „evidence based“ medicíny v kardiologii
J. Widimský
Kardiologie patří k oborům, kde se nejvíce uplatňují poznatky „evidence based“ medicíny. Důkazy je např. podložena léčba ischemické choroby srdeční statiny, léčba hypertenze, léčba chronického srdečního selhání betablokátory a např. také postoj k trombolytické léčbě akutního infarktu myokardu. Existují však diagnózy, u nichž stěží někdy získáme poznatky „evidence based“ medicíny. Jako příklad uvedl prof. Widimský léčbu hypertenze v těhotenství a léčbu hypertenzní krize.
Prakticky významná může být námitka, že naprostá většina studií související s problematikou oboru kardiologie má za sponzora farmaceutickou firmu. Bývalý president EKS prof. Hugenholtz sice usiloval o vytvoření nezávislého odborného orgánu, který by plánoval, financoval a řídil studie, jejichž finanční zabezpečení by bylo nezávislé. Snaha však nebyla úspěšná.
Financování studií firmami má však vedle rizika i své klady: mortalitní studie jsou neobyčejně finančně náročné. Výsledek není zaručený (např. výsledek léčby srdečního selhání antagonisty cytokinů, nebo antagonisty endotelinových receptorů, paradoxní důsledky měla studie týkající se trombolytické léčby u AIM a plicní embolie). Úskalím je také skutečnost, že pozornost je věnována přednostně častým onemocněním.
Dalším úskalím „evidence based“ medicíny je také v tom, že nepřesvědčivé výsledky studií bývají někdy nesprávně interpretovány příliš pozitivně.
Jako příklad k ilustraci zvolil prof. Widimský studii SENIORS – léčba chronického srdečního selhání nebivololem. Výsledky nebyly příliš přesvědčivé. Celková mortalita poklesla o 12 %. Bylo to proto, že do studie byli zahrnuti nemocní bez přítomnosti dalších významných onemocnění a bez významnější systolické dysfunkce – šlo tedy o chybu plánu studie nebo se jednalo o důsledek léčby nebivololem? Účastníci studie měli, jak je obvyklé, sklon k optimistické interpretaci výsledků.
Studii ALLHAT uvedl prof. Widimský jako příklad, že ani nezávislé studie nejsou prosté chyb: při porovnávání účinnosti diuretika, ACE inhibitoru a blokátoru kalciových kanálů nebyla správně zhodnocena skutečnost, že 1/3 souboru tvořili Afroameričané, kteří reagují hůře na ACE inhibitory a betablokátory. Pro kombinační léčbu byly vybrány léky již nepoužívané, v závěru byla zdůrazňována diuretika, ačkoliv po chlorthalidonu se manifestoval diabetes mellitus o 43 % častěji než po lisinoprilu atd.
Úskalím „evidence based“ medicíny může být, pokud jsou nemocní v klinických studiích „méně“ nemocní nežli nemocní v praxi. Věk nemocných by neměl být nižší než v praxi. Častost průvodních onemocnění by neměla být nižší než v praxi. Navíc jsou nemocní v klinických studiích pečlivěji sledováni než nemocní v praxi.
„Evidence based“ medicína však umožňuje získat poznatky o léčbě, které nelze získat empirií. Umožňuje také získat poznatky o nežádoucích účincích nových léků, které v době registrace nebyly známy. Studie je však nutno správně interpretovat. Je nezbytné respektovat zařazovací a vylučovací kritéria studie, podrobně sledovat nejen kladné výsledky studií, ale všímat si také nežádoucích účinků léků. Nejcennější jsou studie, které byly předčasně ukončeny pro významné výsledky. Cenné jsou i studie negativní (např. CAST, MOXCON prokázaly zvyšování mortality při terapii!). Méně přesvědčivé jsou studie se slabším „sparring“ partnerem.
V závěru přednášky prof. Widimský zdůraznil, že při zavádění nových léků do praxe je třeba si zachovat kritickou mysl. Varoval před předčasným entuziasmem (viz mibefradil, cerivastatin, COX-2 inhibitory). Upozornil také, že ne vždy je možno převzít prezentované poznatky pro každého nemocného. Na řadě dalších konkrétních příkladů ilustroval možnost vzniku nesprávné interpretace zjištěných dat (SENIORS, RALES, ELITE I a II).
Poznámka referujícího:
V medicíně se údajně za 5 let pozmění až 30 % informací. Které to budou, nikdo předem neví, které to byly, ví jen někteří, a to většinou jen z části. Je zřejmé, že stále platí, že praktická medicína i nadále zůstává uměním: umění rozpoznávat přesné a správné informace, umění je včas a správným způsobem uplatňovat ku prospěchu zcela určitých nemocných. Umění však je i zjistit, zda, v čem a jak moc se naši nemocní podobají těm, jejichž sledování poskytlo klíčové výsledky studií.
Oba přednášející nepochybně umějí studie organizovat, hodnotit i interpretovat jejich poselství. Díky za poskytnuté rady, pro naše nemocné existenčně významné.
Pokud bude zájem čtenářů, snad časopis poskytne další prostor pro případnou diskusi.
MUDr. Lubomír Berka, CSc.
t.č. předseda Pracovní skupiny ambulantních kardiologů ČKS.
Autotransplantace kmenových buněk v léčbě ICHS
(diskusní příspěvek „pro“ v diskuzi „pro a proti“ v rámci XIII. výročního sjezdu ČKS)
Regenerace poškozeného myokardu implantací kmenových buněk je jednou z cest, jak řešit problém nárůstu počtu nemocných s městnavou srdeční slabostí. Následující text bude vycházet ze zkušeností s autologní transplantací mononukleárních buněk kostní dřeně, které jsou hlavním zdrojem kmenových buněk dospělých jedinců („adult stem cells“).
Po řadě experimentálních studií na zvířecím modelu, které popsaly transdiferenciaci kmenových buněk do myocytů či buněk cévních struktur, byly zahájeny klinické projekty s cílem regenerovat poškozený myokard. Tyto projekty použily autologní transplantaci mononukleárních buněk kostní dřeně s cílem zlepšit perfuzi a funkci myokardu nevratně poškozeného akutním infarktem či myokardu hibernovaného u nemocných s chronickou ischemickou chorobou srdeční (ICHS). Zahájení léčby kmenovými buňkami v klinice je v současnosti spojeno s diskusí o oprávněnosti této léčby, neboť se v poslední době objevily práce zpochybňující proces transdiferenciace „adult stem cells“ do myocytů a některé údaje o možných rizicích spojených s podáním kmenových buněk. Jaká fakta hovoří pro pokračování v provádění těchto klinických studií? Z analýzy dosud zveřejněných originálních prací celkem jednoznačně vyplývá, že autologní transplantace mononukleárních buněk kostní dřeně při současně užívané metodice (transplantace neselektovaných mononukleárních buněk, speciálně nemnožených či neupravovaných, nestimulovaných různými látkami, apod) splňuje 2 základní předpoklady úspěšné léčby – její bezpečnost a její účinnost. Na skutečnosti, že léčba je bezpečná a účinná, se shodují výsledky všech dosavadních klinických studií u akutního infarktu myokardu [1-7] i chronické ICHS [8-12]. Při hodnocení účinnosti je třeba navíc vzít v úvahu velký potenciál této metody pro další zlepšování výsledků zdokonalením dosud velmi jednoduché metodiky používané v klinických studiích. Za nedostatky lze považovat malé počty nemocných v klinických studiích, chybění randomizace většiny z nich, zahrnutí nemocných většinou jen s mírným postižením funkce myokardu a chybění dlouhodobějších dat o bezpečnosti a účinnosti léčby. Tyto nedostatky však nehovoří proti provádění této léčby, ale spíše by měly podnítit další studie k jejich vyřešení. Hlavní námitkou proti léčbě kmenovými buňkami v klinice je v současnosti nedořešený mechanizmus účinku této léčby. Jak již bylo zmíněno, některé nejnovější studie totiž zpochybnily proces transdiferenciace „adult stem cells“ do myocytů, který byl v době zahájení klinických studií považován za hlavní mechanizmus zlepšení funkce v poškozeném myokardu. Je třeba říci, že v tuto chvíli nelze, na základě známých skutečností, bezpečně proces transdiferenciace „adult stem cells“ do myocytů potvrdit ani odmítnout. Nicméně i v případě, že tento mechanizmus zlepšení funkce a perfuze odmítneme, může autologní transplantace mononukleárních buněk kostní dřeně vést ke zlepšení funkce a perfuze myokardu dalšími mechanizmy. Patří k nim parakrinní účinek transplantovaných buněk (zprostředkovaný sekrecí cytokinů, růstových faktorů), aktivace „srdečních kmenových buněk“ („cardiac stem cells“) i příznivé ovlivnění remodelace levé komory.
Na základě zatím zveřejněných prací lze shrnout, že autologní transplantace mononukleárních buněk kostní dřeně se dosud jeví jako bezpečná metoda zlepšující funkci a perfuzi infarktového ložiska. Bezpečnost a účinnost této metody však musejí být potvrzeny velkými randomizovanými studiemi, které by měly být prováděny jen na pracovištích s dostatečným vybavením a zkušenostmi s danou problematikou. V tuto chvíli je metodu třeba chápat jako výzkumnou a nikoliv jako ověřenou léčbu akutního infarktu myokardu či chronické ICHS s přítomností hibernovaného myokardu. Je třeba rychle dořešit nevyjasněné otázky prostřednictvím experimentálních studií a do získání dalších dat autor nedoporučuje v klinických studiích s transplantovanými buňkami speciálně manipulovat (stimulace cytokiny, růstovými faktory, apod).
Literatura
1. Strauer BE, Brehm M, Zeus T et al. Intrakoronare, humane autologe Stammzelltransplantation zur Myokardregeneration nach Herzinfarkt. Dtsch med Wschr 2001; 126: 932-8.
2. Strauer BE, Brehm M, Zeus T et al. Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans. Circulation 2002; 106(15): 1913-8.
3. Assmus B, Schachinger V, Teupe C et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction (TOPCARE-AMI). Circulation 2002; 106(24): 3009-17.
4. Britten MB, Abolmaali ND, Assmes B et al. Infarct remodeling after intracoronary progenitor cell treatment in patients with acute myocardial infarction (TOPCARE-AMI). Mechanistic insights from serial contrast-enhanced magnetic resonance imaging. Circulation 2003; 108(18): 2212-8.
5. Fernández-Avilés F, San Román JA, García-Frade J et al. Experimental and clinical regeneration capability of human bone marrow cells after myocardial infarction. Circ Res 2004; 95(7): 742-8.
6. Schachinger V, Assmus B, Britten MB et al. Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction. Final one-year results of the TOPCARE-AMI trial. J Am Coll Cardiol 2004; 44(8): 1690-9.
7. Wollert KC, Meyer GP, Lotz J et al. Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomized controlled clinical trial. Lancet 2004; 364(9429): 141-8.
8. Stamm Ch, Westphal B, Kleine HD et al. Autologous bone-marrow stem-cell transplantation for myocardial regeneration. Lancet 2003; 361(9351): 45-6.
9. Hamano K, Nishida M, Hirata K et al. Local implantation of autologous bone marrow cells for therapeutic angiogenesis in patients with ischemic heart disease. Jpn Circ J 2001; 65(9): 845-7.
10. Tse HF, Kwong YL, Chan JKF et al. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation. Lancet 2003; 361(9351): 47-9.
11. Perin EC, Dohmann HFR, Borojevic R et al. Transendocardial, autologous bone marrow cell trasnplantation for severe, chronic ischemic heart failure. Circulation 2003; 107(18): 2294-302.
12. Fuchs S, Satler LF, Kornowski R et al. Catheter-based autologous bone marrow myocardial injection in no-option patients with advanced coronary artery disease. J Am Coll Cardiol 2003; 41(10): 1721-4.
prof. MUDr. Jaroslav Meluzín, CSc., FESC
I. interní kardioangiologická klinika
FN u sv. Anny, Brno
Jsou „Doporučení pro léčbu chronického srdečního selhání“ použitelná i u nemocných vyššího věku ?
J. Špác
Chronické srdeční selhání (CHSS) je u seniorů jednou z nejčastějších příčin hospitalizace s 1roční mortalitou dosahující až 30 % s prevalencí stoupající s věkem a dosahuje až 10 % u starších osob. S narůstajícím věkem se zvyšuje zastoupení žen. Příčinou jsou změny srdeční funkce s vysokým výskytem diastolické dysfunkce a dystrofických srdečních vad u starších nemocných. Navíc řada rizikových faktorů srdečního selhání (hypertenze, diabetes, dyslipidemie) není u starších nemocných dostatečně léčena a je přítomna řada přidružených onemocnění (ledvinné, endokrinní, hematologické) modifikujících klinické projevy srdečního selhání a odpověď na léčbu. Hodnocení ledvinných funkcí jen pomocí hladiny kreatininu je nepřesné, mnohem přesnější je použití výpočtu glomerulární filtrace podle některých predikčních vzorců pro výpočet glomerulární filtrace nebo hodnocení pomocí plazmatické hodnoty cystatinu C, jehož hladina v séru není významně ovlivňována vlivy, jako je dieta, infekce, svalová hmotnost, a jeho koncentrace v plazmě je závislá především na glomerulární filtraci.
Přidružená onemocnění také modifikují příznaky CHSS, které jsou často atypické a vedou k omylům v diagnostice. Klasické příznaky mají nízkou senzitivitu a některé i nižší specificitu. Hodnocení často se vyskytující diastolické dysfunkce levé komory srdeční pomocí neinvazivních metod je v terénní praxi obtížnější než diagnostika poškozené systolické funkce, protože drtivá většina diastolických ukazatelů levé komory se mění se vzrůstajícím věkem stejně jako hodnoty BNP, které jsou méně spolehlivé než u mladších nemocných. Přesto je echokardiografické vyšetření spojené s klinickým vyšetřením (a ideálně doplněné hodnocením u nás rutinně zatím nedostupného BNP) základem neinvazivní diagnostiky CHSS u starších nemocných. Přidružené choroby vedou k častému výskytu kardiorenálního, kardiorespiračního a kardioseptického syndromu.
Také léčba nemocných je komplikovanější v důsledku změn provázejících stárnutí, jako je zmenšení svalové hmoty, snížení funkce ledvin, zmenšení obsahu tělesné vody a změn krevních bílkovin způsobujících změny farmakokinetiky a farmakodynamiky. Polymorbidita starších nemocných je spojena s vyšším výskytem kontraindikací řady léků a vede k polypragmazii se sníženou kompliancí a řadou nežádoucích lékových interakcí týkajících se diuretik, ACE-inhibitorů, betablokátorů a inotropních látek. Zvláště potencionálně nebezpečná může být v této věkové kategorii kombinace ACE-inhibitorů, antagonistů aldosteronu a diuretik vedoucí k hyperkalemii a prerenálnímu ledvinnému selhávání. Nemocní nad 75 let jsou také nedostatečně zastoupeni v klinických studiích CHAS, a proto důkazy o účinnosti a bezpečnosti léčby srdečního selhání jsou nedostatečné. V poslední době vzrůstá množství údajů o léčbě této populace nemocných, jak ukazují studie SENIORS a COLA II s vazodilatačním betablokátorem karvedilolem, potvrzující bezpečnost a výhodnost této léčby.
Lze říci, že základní principy odborných doporučení jsou platné a použitelné i u nemocných staršího věku, ale nesmíme je používat bezmyšlenkovitě a musíme umět je u individuálního nemocného sladit s léčbou dalších onemocnění.
doc. MUDr. Jiří Špác, CSc.
II.interní klinika FN U sv. Anny v Brně
HOT LINES
J. Špinar
V sekci HOT LINES v pondělí 9.5. 2005 zaznělo celkem 7 sdělení s výsledky posledních klinických studií.
Doc. MUDr. Lenka Špinarová, Csc. představila studii SENIORS (Study of the Effects of Nebivolol Intervention on Outcomes and Rehospitalisation in Seniors with Heart Failure - Eur Heart J 2005; 26(3): 215-225), která měla za cíl zhodnotit účinek nebivololu na morbiditu a mortalitu starších pacientů s chronickým srdečním selháním, bez ohledu na ejekční frakci.
Vstupním kritériem byl věk nad 70 let a srdeční selhání definované jako: hospitalizace pro městnavé srdeční selhání v posledních 12 měsících nebo ejekční frakce levé komory nižší než 35 % při hodnocení v posledních 6 měsících. Podávání nebivololu bylo zahájeno dávkou 1,25 mg denně za postupné titrace přes 2,5mg a 5mg dávku na cílovou dávku 10 mg. Minimální doba sledování byla 12 měsíců.
Celkem bylo zařazeno 2 135 pacientů z 11 zemí. Česká republika zařadila 312 pacientů. Průměrná doba sledování byla ve skupině nebivololu 1 863 pacientských let a 1 839 pacientských let v placebové skupině.
Primární cíl - kombinace úmrtí nebo hospitalizace z kardiovaskulárních příčin - byl ve skupině s nebivololem 31,1 % vs 35,3 % u placeba (p < 0,039). Snížení absolutního rizika je 4,2 %, což představuje potřebu léčit (NNT) 24 pacientů po dobu 21 měsíců k zabránění 1 události. Celková mortalita se ve skupině nebivololu a placeba nelišila: 15,8 % vs 18,1 %, p < 0,21. Náhlá smrt se vyskytla ve skupině nebivololu v 36 % a v placebové skupině ve 48 %.
Ve studii SENIORS byl prokázán příznivý efekt nebivololu jak pro pacienty s nízkou, tak zachovalou ejekční frakcí levé komory. Nebivolol by mohl být prospěšný pro pacienty se srdečním selháním bez ohledu na ejekční frakci.
Prof. MUDr. Jiří Vítovec, CSc. představil studii PEACE (Prevention of Events with Angiotensin Converting Enzyme Inhibition Trial - N Engl J Med 2004; 351: 2058-2068), která testovala hypotézu (primární cíl studie), zda se u nízko rizikových pacientů s prokázanou ICHS potvrdí účinnost ACE-I ve srovnání s placebem na snížení úmrtí z kardiovaskulárních příčin či snížení vzniku nefatální infarktu myokardu. Sekundárním cílem studie byl složený cíl: kardiovaskulární úmrtí, nefatální IM a koronární revaskularizace. Do studie bylo zahrnuto 8 290 nemocných. Zařazovací kritéria byla věk 50 a více let, ICHS dokumentovaná infarktem myokardu, aortokoronárním bypassem (CABG) či koronární angioplastikou (PTCA) před více než 3 měsíci, či stenózou nejméně 1 koronární tepny nad 50 %. Ejekční frakce nad 40 %, normální kinetika levé komory při ventrikulografii či echokardiografickém vyšetření. Nemocný musel tolerovat léčbu ACE-inhibitorem v run-in fázi s více než 80% adherencí k léčbě. Dávka trandolaprilu byla titrována dle tolerance do 4 mg . Nebyl pozorován statisticky významný efekt na snížení primárního cíle, na celkovou mortalitu či na nový infarkt myokardu. Byl pozorován významný trend na snížení cévních mozkových příhod, statisticky významné snížení hospitalizací či úmrtí na srdeční selhání a statisticky významné snížení výskytu nového diabetes mellitus.
Prof MUDr Jindřich Špinar představil studii CAMELOT - Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure - JAMA 2004; 292: 2217-26), která srovnává účinek amlodipinu (10 mg) nebo enalaprilu (20 mg) oproti placebu u nemocných s ischemickou chorobou srdeční a průměrnou hodnotou krevního tlaku v oblasti normálního až optimálního krevního tlaku. Celkem bylo zařazeno 1 991 nemocných s angiograficky dokumentovanou ischemickou chorobou srdeční.
Studie CAMELOT ukázala poměrně významný pokles kardiovaskulárních příhod u nemocných se stabilní ischemickou chorobou srdeční a normálním krevním tlakem. Počet nemocných potřebných léčit amlodipinem vs placebo na zábranu jedné kardiovaskulární příhody byl 16. Ukazuje se, že současná doporučení pro kontrolu hypertenze u nemocných s ischemickou chorobou srdeční nejsou dostatečná a že bychom krevní tlak měli snižovat mnohem více než na hodnoty 149/90 mmHg.
Studie CAMELOT je třetí z klinických studii v řadě za sebou (po studiích ALLHAT a VALUE), které neprokazují v přímém srovnání větší účinek látek blokujících systém renin-angiotenzin (ACE-I či AIIA) ve srovnání s amlodipinem.
Prof. MUDr. Jiří Widimský jr. představil studii ASCOT BPLA – Anglo–Scandinavian Cardiac Outcomes Trial – Blood pressure lowering arm (přednesena na ACC v Orlandu, březen 2005). ASCOT (Anglo-Scandinavian Cardiac Outcome Trial) hodnotila vliv léčby amlodipinu±perindoprilu v porovnání s léčbou atenololem+/-bendroflumethiazidem na snížení kardiovaskulárních příhod. Studie zahrnula více než 19 000 pacientů s hypertenzí a dalšími nejméně 3 kardiovaskulárními rizikovými faktory, avšak bez zjevné ischemické choroby srdeční (ICHS). Kombinace amlodipin/perindopril byla přítomna u 85,7 % pacientů této větve, kombinace atenolol/bendroflumethiazid dokonce u 91,4 %. Z výsledků vyplývá, že léčba amlodipinem/perindoprilem významně snížila celkovou (14 %) a kardiovaskulární (24 %) mortalitu, fatální a nefatální CMP (23 %) a vznik nového diabetes mellitus (32 %) v porovnání s léčbou atenololem/bendroflumethiazidem. Snížení primárního end pointu (nefatální IM a fatální ICHS) o 10 % nedosáhlo statistické významnosti, pravděpodobně z důvodu předčasného ukončení studie.
Prof. MUDr. Petr Widimský, Csc. prezentoval studii PCAT. Nejedná se přímo o randomizovanou studii, ale o metaanalýzu několika mortalitních studií srovnávajících u akutního infarktu myokardu s ST elevacemi strategii okamžitého transportu do katetrizační laboratoře proti trombolýze a případně následné elektivní angiografii a ošetření. Metaanalýza ukázala, že strategie okamžitého transportu je prospěšnější ve všech případech, kdy je katetrizační laboratoř dosažitelná do 60 minut. Čas, který se ztrácí transportem, je plně kompenzován ztrátou času při postupném nástupu trombolýzy, takže reálná doba rekanalizace od zavolání je u direktní PTCA a trombolýzy téměř shodná. Metaanalýza ukázala, že direktní PTCA měla menší počet úmrtí, reinfarktů a rekatetrizací ve všech podskupinách nemocných a byla prospěšnější bez ohledu na čas od vzniku příznaků, tedy i v prvních 90 resp. 180 minutách, kde některé studie udávaly lepší výsledky po trombolýze.
MUDr. Miloš Táborský prezentoval studii SC-HEFT (Sudden Cardiac Death in Heart Failure Trial), která měla zodpovědět, zda amiodaron nebo ICD (programovaný pouze na výboj) sníží v porovnání s placebem celkovou mortalitu. Zařazeni byli nemocní s ischemickým i neischemickým srdečním selháním NYHA II-III a EF < 35 %. Zařazeno bylo 2 521 nemocných (829 ICD, 845 amiodaron a 847 placebo). Průměrný věk nemocných byl 60 let, 52 % nemocných mělo prokázanou ischemickou chorobu srdeční. Po 3 letech byla nejnižší mortalita (17 %) u nemocných s ICD, na placebu 22 % a na amiodaronu 24 %. Po 5 letech ICD 29 %, placebo 36 % a amiodaron 34 %. Prospěch z léčby ICD měli nemocní s ICHS i bez ICHS, jak ve funkční třídě NYHA II, tak i NYHA III.
MUDr. Michael Želízko prezentoval intervenční studii REALITY, která srovnávala pokrývané stenty a nenalezla mezi nimi větší rozdíl. Ve většině ukazatelů a podskupin však byl trend k lepším výsledkům u stentů pokrývaných sirolimem než paclitaxelem.
Gudeilines pro akutní srdeční selhání
Pracovní skupina Srdeční selhání a pracovní skupina Akutní kardiologie připravily zcela nová Doporučení pro diagnostiku a léčbu akutního srdečního selhání. Tato doporučení vycházejí z čerstvě publikovaných doporučení evropských (Eur Heart J 2005; 26(4): 383-416), veřejnou oponenturu budou mít na podzim na kardiologickém dni a publikována by měla být v prosinci 2005. Ze společného návrhu vybíráme.
Pro diagnózu akutní srdeční selhání musí být splněna 2 z následujících 3 kritérií:
- náhle vzniklé symptomy srdečního selhání (v klidu nebo při zátěži)
- prokázaná porušená srdeční funkce (v klidu)
- odpověď na léčbu (v případě, že diagnóza je sporná).
Symptomy mohou vzniknout u nemocného se známým předchozím onemocněním srdce, ale i bez něho. Porušená srdeční funkce může být systolická, diastolická i smíšená, projevem porušené srdeční funkce mohou být i poruchy rytmu. Stav je často život ohrožující a vyžaduje okamžitý léčebný zásah.
Klinické projevy můžeme rozdělit do 6 základních skupin:
- Akutní dekompenzace srdečního selhání (nově vzniklé, nebo nasedající na chronické srdeční selhání), nesplňující kritéria kardiogenního šoku, plicního edému či hypertenzní krize.
- Hypertenzní krize se srdečním selháním – klinické projevy srdečního selhání jsou následkem hypertenzní reakce, systolická funkce srdeční může být normální, nebo jen mírně snížená, je klinický a RTG obraz plicního edému.
- Plicní edém provázený jiným plicním postižením – těžká dušnost, chrůpky, saturace < 90 %.
- Kardiogenní šok – projevuje se těžkou hypoperfuzí tkání z důvodů nízkého minutového výdeje a krevního tlaku. Systolický krevní tlak < 90 mmHg, nebo pokles středního krevního tlaku o > 30 mmHg u hypertoniků a/nebo minutový srdeční výdej < 0,5 ml/kg/hod. Tepová frekvence > 60/min, většinou tachykardie > 100/min. Známky poškození cílových orgánů.
- Srdeční selhání s vysokým výdejem – speciální situace s teplou periferií, plicní kongescí a různým krevním tlakem. Doprovází tyreotoxikózu, anémie, Pagetovu nemoc, výjimečně sepsi.
- Pravostranné srdeční selhání s nízkým minutovým výdejem, zvýšenou náplní jugul, kongescí v játrech a hypotenzí.
Klinická klasifikace používá dělení do 4 skupin (podle nálezu na kůži):
- teplý a suchý – fyziologický nález
- teplý a mokrý – plicní edém
- studený a suchý – hypovolemický šok
- studený a mokrý – kardiogenní šok.
Výskyt srdečního selhání má neustále vzrůstající tendenci především kvůli stárnutí populace a výrazně zlepšené péči o akutní koronární syndromy - ekonomická náročnost léčby srdečního selhání představuje dnes ve vyspělých evropských zemích 1-2 % veškerých nákladů do zdravotnictví. Prognóza onemocnění je závažná, u nemocných s akutním srdečním selháním je roční mortalita 30 % a 5letá 90 %.
Monitorace nemocného s ASS má být zahájena neprodleně po jeho přijetí na lůžko intenzivní péče současně se zahájením diagnostických postupů k určení primární příčiny. Druh a rozsah monitorace bude u každého nemocného individuální v závislosti na stupni závažnosti srdeční dekompenzace a odpovědi na zahájenou léčbu. Předložená doporučení monitorace u ASS jsou založena především na zkušenostech odborníků s léčbou těchto nemocných.
Kyslík je doporučen při známkách hyposaturace, morfin je doporučován nemocným v kritickém stavu s akutním srdečním selháním a těžkým nedostatkem dechu.
Vazodilatační léčba je u většiny nemocných s akutním srdečním selháním (ASS) indikována jako léčba první volby, v popředí jsou především nitráty. Kličková diuretika intravenózně se používají u plicního edému. Katecholaminy jsou lékem volby, u hypotenzních nemocných používá se dopamin, dobutamin a adrenalin.
Do popředí léčby akutního srdečního selhání se dostal levosimendan (kalciový senzitizér), který je indikován především u dekompenzace chronického srdečního selhání, na ústupu jsou naopak inhibitory fosfodiesterázy.
ACE inhibitory při akutním srdečním selhání nikdy nenasazujeme, již nasazenou léčbu je možno přerušit, betablokátory můžeme výjimečně použít u akutního koronárního syndromu s hypertenzí a tachykardií; již nasazené betablokátory nevysazujeme, ale snižujeme dávku. Digitalis je indikován u fibrilace síní, již nasazený digitalis můžeme na 2-3 dny vysadit
Výrazný pokrok ve vývoji mechanických srdečních podpor a náhrad bude v budoucnu zvyšovat počet potenciálních kandidátů pro tento přístup, a to jak pro krátkodobé, tak i dlouhodobé použití, zatím se používají především krátkodobé podpory s nutností pobytu na lůžku.
Intraaortální balonková kontrapulzace je indikována u nemocných s kardiogenním šokem nebo závažným levokomorovým ASS, kteří nereagují rychle na komplexní farmakologickou léčbu. Největší prospěch lze očekávat u nemocných s korigovatelnou příčinou ASS k překlenutí kritické fáze do konečného řešení.
prof. MUDr. Jindřich Špinar, Csc., FESC
Interní kardiologická klinika, FN Brno-Bohunice
Statiny pro a proti
V rámci XIII. sjezdu ČKS zaznělo několik duelů pro a proti. Jeden z nich připravila i Pracovní skupina „Srdeční selhání“ na téma Jsou statiny dalším přínosem v léčbě pacientů s chronickým srdečním selháním? V roli obhájce statinů vystoupil prof. MUDr. J. Hradec, CSc., odpůrkyní byla doc. MUDr. L. Špinarová, PhD. Do křesla soudců tohoto duelu zasedli prof. MUDr. J. Vítovec, CSc. a doc. MUDr. J. Špác,CSc.
Jako první vystoupil prof. Hradec, který uvedl důvody, proč by statiny měly být používány v léčbě srdečního selhání. Na úvod své přednášky citoval z Doporučení pro diagnostiku a léčbu chronického srdečního selhání České kardiologické společnosti, kde je napsáno, že indikace hypolipidemik pro nemocné s chronickým srdečním selháním (CHSS) ischemické etiologie je stejná jako pro nemocné s ischemickou chorobou srdeční (ICHS) v sekundární prevenci. Naproti tomu Evropská doporučení pro diagnostiku a léčbu CHSS se o hypolipidemické léčbě vůbec nezmiňují. Americká doporučení rozdělují pacienty s CHSS do 4 tříd: A = vysoké riziko pro vznik CHSS, B = asymptomatická systolická dysfunkce levé srdeční komory (LK), C = symptomatická dysfunkce LK a D = pokročilé refrakterní CHSS. Ve všech 4 třídách je doporučeno léčit hyperlipidemie v souladu s příslušnými guidelines.
Co tedy říkají současná guidelines? Doporučují hypolipidemickou léčbu u nemocných s prokázanou ICHS a plazmatickou koncentrací celkového cholesterolu vyšší než 5 mmol/l. Tato guidelines ale vycházejí z výsledků primárně a sekundárně preventivních studií, do kterých však nebyli zařazeni pacienti se středně těžkým a těžkým CHSS. Ve studiích 4S, WOSCOPS, CARE, LIPID, AFCAPS a HPS bylo jednoznačně prokázáno významné snížení mortality u nemocných, kteří byli léčeni statiny ve srovnání s těmi, kteří užívali placebo. Ze studie 4S však byli vyloučeni všichni nemocní vyžadující léčbu digoxinem, diuretiky nebo vazodilatancii.
Z primárně preventivních studií WOSCOPS a AFCAPS byli vyloučeni všichni nemocní s CHSS. Ze studií CARE a LIPID byli vyloučeni nemocní se symptomatickým CHSS. Ze studie HPS byli vyloučeni nemocní se závažným CHSS. Její publikace neobsahuje žádné informace o podskupině nemocných s CHSS.
Vzhledem k tomu, že 70 % pacientů má CHSS na podkladě ICHS, zdá se být logické, že statiny sníží morbiditu a mortalitu i u nemocných s CHSS ischemické etiologie. Dodatečná podskupinová analýza výsledků studie 4S ukázala, že nemocní, u kterých se vyvinulo v průběhu studie CHSS, měli srdeční infarkt častěji než pacienti bez CHSS (52 vs 16 %). Ve studii CARE snížil pravastatin výskyt akutních koronárních příhod jak u pacientů s CHSS, tak bez něho. Podobně ve studii 4S snížila léčba simvastatinem mortalitu jak nemocných bez CHSS, tak s CHSS.
Předpokládané příznivé účinky statinů při CHSS by mohly spočívat ve:
- stabilizaci aterosklerotických plátů
- zlepšení endoteliální funkce, stimulaci neoangiogeneze
- down-regulaci receptorů AT1
- inhibici prozánětlivých cytokinů
- či příznivé modulaci autonomního nervového systému.
Jako správný gentleman připustil prof. Hradec i možné negativní účinky statinů, které potom přednesla i jeho oponentka. Uvedl, že nízké plazmatické koncentrace cholesterolu jsou spíše než příčinou horší prognózy markerem pokročilého srdečního selhání a katabolického stavu. Proto jsou v observačních studiích spojeny s horší prognózou.
Jsou tedy důsledkem, nikoliv příčinou prognosticky závažného stavu.
Na závěr prof. Hradec uvedl nedávné výsledky retrospektivní analýzy souboru 2 331 ambulantních pacientů s CHSS z registrů argentinského projektu GESICA. Tito nemocní byli sledovaní 957 dnů. Celková mortalita byla vyšší u pacientů bez statinů než u těch, kteří statiny užívali (26,8 vs 16,1 %; p < 0,001). Podobné výsledky ve prospěch statinů přinesla i retrospektivní analýza dat nemocných s pokročilým srdečním selháním (NYHA III-IV) ze studie COMPANION. Svoji přednášku zakončil prof. Hradec konstatováním, že dokud nebudou k dispozici výsledky prospektivní, randomizované, dvojitě slepé mortalitní studie CORONA, nelze učinit definitivní závěr o oprávněnosti podávání statinů u pacientů s CHSS.
Doc. Špinarová naopak hájila názor, že statiny nemají v léčbě pacientů s CHSS své místo. Nejprve poukázala na to, že výsledky o prospěšnosti statinů při CHSS jsou založeny na výsledcích primárně a sekundárně preventivních studií se statiny. Hodnocení pacientů, u kterých se vyskytlo srdeční selhání v průběhu těchto studií, je retrospektivní. Z těchto výsledků tedy nelze doporučit podávání statinů pacientům s CHSS. Jako hlavní argumenty proti statinům bylo použito následujících 5 bodů:
- V retrospektivních observačních studiích bylo pozorováno, že nemocní s CHSS, kteří mají nižší cholesterol, mají vyšší mortalitu. Tyto výsledky nebyly ovlivněny tím, zda pacient byl či nebyl kachektický.
- Snížení koncentrace lipoproteinů statiny může mít za následek snížení ochrany proti endotoxinům, které se dostávají do cirkulace ze střeva. Lipoproteiny totiž na sebe váží endotoxiny a detoxikují je. Při snížení koncentrace lipoproteinů mohou endotoxiny vést ke zvýšené tvorbě „tumor necoris factor alfa“ (TNFα), který je u CHSS škodlivý a je také markerem horší prognózy pacientů.
- Oslabení účinku inhibitorů ACE léčbou statiny. Při zvýšené koncentraci cholesterolu totiž dochází ke zvýšené expresi receptorů AT1, a tím k lepšímu působení inhibitorů ACE. Tento možný mechanizmus je uváděn při interpretaci nečekaně negativních výsledků studie PEACE. V této studii bylo 70 % pacientů při zařazení léčeno statiny. To může být důvodem, proč trandolapril nevedl u těchto pacientů k významnému snížení mortality.
- Polyfarmacie. Pacienti s CHSS jsou starší, mají obvykle četné komorbidity a i bez statinů užívají značné množství léků. Podle publikované analýzy užívá 35 % pacientů 4-6 léků, 37 % pacientů 7-9 léků a 20 % pacientů více než 10 léků. S přibývajícím počtem užívaných léků samozřejmě klesá kompliance nemocných k léčbě.
- Se stoupajícím počtem užívaných léků také geometricky roste počet možných lékových interakcí. Statiny mohou mít závažné interakce s řadou léků, které pacienti s CHSS často užívají.
V závěru se doc. Špinarová shodla se svým oponentem, že až do ukončení prospektivní, randomizované, dvojitě slepé mortalitní studie CORONA neexistuje důkaz pro přidání statinů do léčby srdečního selhání. Je tedy potřeba počkat na výsledky studie CORONA, které otázku, zda statiny patří do léčby CHSS, zodpoví pravděpodobně koncem roku 2007.
doc. MUDr. Lenka Špinarová, PhD.1
prof. MUDr. Jindřich Hradec, CSc.2
1 I. interní kardioangiologická klinika, FN U sv. Anny, Brno
2 3. interní klinika 1. LF UK a VFN, Praha
Kardiovaskulární farmakoterapie na XIII. sjezdu ČKS 2005
Na XIII. Sjezdu ČKS byla problematika farmakologické léčby KV onemocnění připravena pracovní skupinou kardiovaskulární farmakoterapie.
Betablokátory (BB) (J. Vítovec) jsou indikovány v léčbě všech forem ICHS (vyjma vazospastické AP), v léčbě supraventrikulárních a komorových tachyarytmií, hypertenze s AP, po AIM, s arytmiemi, po srdečním selhání, u disekce aorty a jsou možné u těhotných nemocných. Při výběru jednotlivých betablokátorů vycházíme z klinické praxe, klinických studií a dle individuální reakce nemocného. Musíme respektovat absolutní kontraindikace - asthma bronchiale, AVB II-III st. a symptomatická hypotenze. U relativních kontraindikací vždy zvažujeme prospěch nemocného oproti riziku nežádoucích účinků. U nemocných s lehkými formami obstrukční plicní nemoci, ischemické choroby DK, diabetes mellitus převažuje v mnohých případech benefit nad rizikem. Indikace betablokátorů třídy IA (jednoznačný souhlas potvrzený 2 a více randomizovanými studiemi): akutní infarkt myokardu, stav po IM, srdeční selhání, prevence fibrilace síní, komorové arytmie při a po IM, prevence náhlé smrti u srdečního selhání či po IM, hypertenze, předoperační kontrola ischemie, hypertenze či arytmií.
Inhibitory ACE (J. Špinar)jsou dnes jednoznačnými léky nejen u hypertenze či srdečního selhání v obou indikacích třídy IA, ale též u stavů po infarktu myokardu, diabetické i neidabetické nefropatii ale také, jak ukázaly studie HOPE, EUROPE a PEACE, i u nemocných s ischemickou chorobou srdeční bez poruchy srdeční funkce. Jejich hlavní vliv v této indikaci, tzn. ICHS bez poruch funkce LK, je ve významném snížení rozvoje srdečního selhání a nového diabetes mellitus. Je nutné pamatovat na možné lékové interakce ACE-I s ostatními léky. Antacida snižují dostupnost, antiflogistika a ASA snižují účinnost, kalium šetřící diuretika a suplementace draslíku může způsobit hyperkalemii a antihypertenziva přidaná v jiných indikacích než u hypertenze mohou navodit symptomatickou hypotenzi.
Protidestičkové léky (J. Bultas) zasahují do procesu adheze, aktivace či agregace trombocytů různými mechanizmy. V současné době se používá řada látek, které ovlivňují funkci destiček různými mechanizmy, nebo přímo inhibují trombin. Kromě kyseliny acetylsalicylové (ASA) jsou v oblasti antiagregačních preparátů k dispozici thienopyridinové deriváty - tiklopidin a klopidogrel, které blokují ADP receptory destiček. Klinická aplikace inhibitorů destičkových glykoproteinových receptorů IIb/IIIa je především v léčbě akutních koronárních syndromů, jednou z hlavních indikací jsou také katetrizační intervence jak v oblasti koronárních tepen, tak tepen periferních. Mechanizmus účinku ASA je v nezvratně blokádě cyklooxygenázy (COX), která je zodpovědná za tvorbu PGH2, prekurzoru TXA2.Thienopyridinové deriváty (tiklopidin a klopidogrel) blokují selektivně a ireverzibilně vazbu ADP na destičkové receptory, a tím brání ADP-dependentní aktivaci komplexu IIb/IIIa a vazbě trombocytů s fibrinogenem a zvyšují antiagregační účinek ASA.
Pozitivně inotropní látky (P. Janský) od klasických vazopresorů přes stimulancia beta 1 či dopaminergních receptorů až po kalciové sensitizéry, jejich představitelem je levosimendan. Pozitivně inotropní látky jsou dnes indikovány u akutního srdečního selhání, při chronickém podávání zvyšují mortalitu hlavně úmrtím na maligní arytmie. Zatím jediným slibným inotropním lékem se jeví levosimendan, ale jeho úloha musí být ověřena v řádných klinických studiích.
V druhém bloku kardiovaskulární farmakoterapie byly podány nové poznatky o endokannabinoidním (EK) systému (J. Hradec), kde nadměrný příjem potravy a kouření aktivujíEK receptory, jejichž selektivní blokátor - rimonabant vede ke snížení obezity a poklesu závislosti na nikotinu. Studie RIO a STRATUS ověřují tyto pozitivní účinky tohoto léku.
Farmakogenetika, účinek léku a lékové interakce (J. Bultas) jsou dnes základním poznatkem ve farmakoterapii, studium cytochromu P-450 a jeho izoenzymu, včetně polymorfizmu určují metabolizaci léku, farmakogenomiku a lékové interakce. Dále účinky léků ovlivňují membránové transportní systémy a cílové receptory.
COX-2 inhibitory a kardiovaskulární riziko (P. Gregor, J. Vítovec) - u specifických inhibitorů COX-2 (= koxiby) se upřednostňoval protizánětlivý efekt s nižším výskytem nežádoucích účinků typu gastroduodenálního vředu a jeho komplikací (perforace, krvácení). Rofekoxib byl zcela stažen z trhu pro významné zvýšení kardiovaskulárních komplikací – především infarktu myokardu a trombotických mozkových cévních příhod. Výsledky vyplynuly z analýzy 3letých dat studie APPROVe - kumulativní výskyt kardiovaskulárních příhod 7,5/1000 léčených u placeba oproti 15 u rofekoxibu. Na možné nepříznivé kardiovaskulární působení léků vzbuzovaly podezření již dříve publikované studie VIGOR (5násobné zvýšení výskytu infarktu myokardu po rofekoxibu, ale i vyšší riziko iktů, hypertenze a flebotrombózy) a studie CLASS s celekoxibem (až po zhodnocení dlouhodobých retrospektivních dat). Ve studii TARGET s lumirakoxibem byl nepříznivý vliv pozorován především u nemocných, kteří neužívali současně aspirin. Výše uvedené nepříznivé účinky jsou pravděpodobně společné všem typům koxibů.
Nové terapeutické rozmezí digoxinu (M. Grundmann) vyplývá hlavně s analýzy studie DIG, kdy bylo nejméně nežádoucích účinků pozorováno u terapeutických hladin mezi 0,5-1,0 nmol/l, což ostravské pracoviště potvrdilo ve svých výzkumech.
O lékem indukovaném prodloužení QT-intervalu a proarytmických důsledcích (J. Bytešník) je známo, že zvyšuje riziko proarytmických účinků různých léků a souvisí s jejich vlivem na repolarizační fázi srdečního cyklu v podobě inhibice draslíkových kanálů – zejména Ikr - což vede k prodloužení akčního potenciálu. Zvýšené riziko proarytmického efektu léků mají pacienti se strukturálním srdečním onemocněním, hepatálním postižením, poruchou iontové balance, bradykardií a s tzv. sníženou repolarizační rezervou, kam mohou spadat latentní formy kongenitálního syndromu dlouhého QT (LQTS). Postup při výskytu proarytmie v průběhu léčby je následující: podezřelý lék vysadit, korigovat možné další příčiny proarytmie, eliminovat bradykardii, pauzy a střídání krátkých – dlouhých - krátkých srdečních cyklů, které přispívají k tzv. disperzi repolarizace a vzniku arytmie. Prevence sekundárního (léky navozeného) LQTS vychází z těchto zásad: nepřekračovat doporučené dávky, nepodávat léky s proarytmickým potenciálem „rizikovým pacientům“ (s těžkou dysfunkcí levé komory, s opakovanou hypokalemií, výraznou bradykardií atd), nepodávat současně léky inhibující systém cytochromu P450, zahajovat léčbu proarytmickými léky při monitoraci EKG.
Na závěr byl podán přehled nově zavedených či registrovaných kardiovaskulárních léků (J. Vítovec, J. Bultas), byly prezentovány: fondaparinux (antitrombotikum), ezetimib (hypolipidemikum), eplerenon (antagonista aldosteronu), ivabradin (selektivní inhibitor kanálu If v SA uzlu a v převodním systému) a ximegalatran (přímý inhibitor trombinu).
prof. MUDr. Jiří Vítovec, CSc., FESC
I. interní kardioangiologická klinika, LF MU a FN U sv. Anny
Konsenzus expertů Evropské kardiologické společnosti o použití protidestičkové léčby u nemocných s aterosklerotickou kardiovaskulární chorobou
J. Kvasnička
V letech 2001-2003 vypracovala skupina expertů Evropské kardiologické společnosti (ECS) ve složení 2 farmakologů (Carlo Patrono a Desmond Fitzgerald), 8 kardiologů (Christopher Bode, Raffaele De Caterina, Bernard Charbonnier, Steen Husted, Gilles Montalescot, Freek Verheugt, Jozef Vermylen a Lars Wallentin), 3 hematologů (Fedor Bachmann, Jack Hirsh a Jan Kvasnička) a 2 epidemiologů (Colin Baigent a Luis Alberto García Rodriguez ) doporučení shrnující poznatky o protidestičkové léčbě u nemocných s aterosklerotickými kardiovaskulárními chorobami na podkladě v té době dostupných výsledků kontrolovaných randomizovaných klinických a epidemiologických studií. Zejména zde bylo čerpáno z prací oxfordské skupiny epidemiologů Antithrombotic Trialists’ Collaboration (BMJ 2002; 324: 71–86), jejíž člen Colin Baigent byl účasten i v této pracovní skupině. Po oponentském řízení další skupinou vybraných expertů ECS byla tato doporučení publikována v European Heart Journal (2004; 25: 166-181). V té době již byla v platnosti i doporučení k antitrombotické léčbě koronárních syndromů amerických kardiologů ACC/ AHA z r. 2002. Souhrnný přehled obou těchto doporučení je uveden v tabulce. V obou lze nalézt vzájemnou shodu.
Ze zásadních názorů skupiny expertů ECS je důležité upozornění na to, že výsledky laboratorních vyšetření inhibice agregace destiček ex vivo nelze interpretovat jako doporučení k použití testovaných léků při prevenci aterotrombózy (viz selhání perorálních fibanů). Důležité jsou jen výsledky kontrolovaných klinických testů. Zde však všechny dnes používané protidestičkové léky (aspirin, tiklopidin, klopidogrel - indikované pro dlouhodobé podávání per os a abciximab, tirofiban a eptifibatid indikované pro krátkodobé podání i.v.) byly vždy úspěšnější než placebo. Dále je zde konstatováno, že testovaní pacienti, pokud patřili do skupiny nemocných s vyšším rizikem kardiovaskulárních chorob, měli z této léčby vždy signifikantní benefit, který převážil riziko použitých léků (krvácení a jiné intolerance). Absolutní redukce opakovaní závažné kardiovaskulární příhody je po léčbě protidestičkovými léky (2/3 aspirinem a 1/3 thienopyridiny) u 36 osob z 1000 v intervalu 2 let po prodělaném infarktu myokardu, dále v intervalu 1 měsíce u 38 osob z 1000 léčených po prodělaném infarktu myokardu, u 36 osob z 1000 nemocných léčených 2 roky pro tranzitorní ischemickou mozkovou příhodu, u 9 z 1000 nemocných takto léčených l měsíc pro akutní ischemický iktus a u 22 osob z 1000 osob s vysokým rizikem kardiovaskulárních komplikací, kteří byli preventivně léčeni protidestičkovými léky (nemocní se stabilní anginou pectoris, periferní arteriální chorobou a fibrilací síní). Dávka aspirinu 75-100 mg denně per os se jeví jako dostatečně účinná jak pro primární, tak i sekundární prevenci kardiovaskulárních komplikací u nemocných s vyšším rizikem ICHS. U osob s nižším rizikem ICHS je ale poměr výše rizika primární preventivní léčby protidestičkovými léky vs benefit léčby zatím nejasný. V dokumentu je dále diskutován účinek jednotlivých protidestičkových léků, včetně jejich dávkování, nežádoucích projevů, kombinací a také vzájemného srovnání účinku při léčbě kardiovaskulárních onemocnění aterosklerotického původu. Co se týká použití tiklopidinu a klopidogrelu, je zde konstatováno, že dle zatím provedených studií je vhodnější klopidogrel. Při dlouhodobém použití má méně nežádoucích projevů a jeho účinek nastupuje dříve. Tento nepřímý inhibitor ADP receptoru P2Y12, který je při sekudární prevenci kardiovaskulárních chorob účinnější než aspirin, nabývá signififikantně na účinku při kombinované léčbě s aspirinem. Účinek obou protidestičkových léků je aditivní. Podle mínění expertů však bude třeba měnit stávající doporučení, která se týkají indikace, doby podání, dávky a délky léčby klopidogrelem při zahájení perkutánní koronární intervence (PCI ). Tento předpoklad se nyní po novém doporučení ECS zvýšit iniciační dávku klopidogrelu z 300 mg na 600 mg (ESC Guidelines for percutaneous coronary interventions, Eur Heart J 2005;26(8): 804-47) ukazuje být správný. Podobné je to i s indikací i.v. inhibitorů GP IIb IIIa. V našem doporučení bylo přidání i.v. inhibitorů GP IIb IIIa k aspirinu a klopidogrelu doporučeno obecně jen k časné revaskularizaci, kde při PCI mají redukovat riziko periprocedurální trombózy. V jiných případech jejich indikace zůstává z hlediska poměru rizika k benefitu léčby zatím nejasná. Tato doporučení však již mohou modifikovat výsledky studie ISAR–REACT po zjištění, že pokud je při PCI použito vysycovací dávky klopidogrelu ve výši 600 mg, nevede další přidání abciximabu i.v. již k žádnému zlepšení (Kastrati A. NEJM 2004; 350: 232-238). Na druhé straně další nová studie (CLEAR platelets trial, ACC 2005) přináší důkazy o tom, že přidání i.v. inhibitoru GP IIb IIIa eptifibatidu k léčbě klopidogrelem ve výši 300 nebo 600 mg snižuje při PCI rezistenci na klopidogrel, reaktivitu destiček a ischemické poškození myokardu. Tato kapitola tedy není ještě uzavřena, zejména pokud dnes do hry vstupují i nové protidestičkové léky, včetně rychlejšího inhibitoru receptoru pro ADP prasugrelu, který je krevními esterázami částečně aktivován již po vstřebání v tenkém střevě.

Závěrem bylo experty ECS doporučeno rozšířit klinická sledování preventivních účinků protidestičkových léků i o studium potlačení aterotrombotických projevů u dalších 2 skupin pacientů s vyšším rizikem vzniku kardiovaskulárních chorob - u diabetiků, kteří ještě nemají ischemické projevy z arteriální okluze v dolních končetinách, a u nemocných s chronickým renálním selháním, u kterých dochází až k 20násobnému nárůstu úmrtí na kardiovaskulární onemocnění v porovnání s jejich incidencí v běžné populaci.
Podpořeno VZ 67 165.
prof. MUDr. J. Kvasnička, DrSc.
1. interní klinika OKH, VFN, Praha
Otazníky okolo resynchronizační terapie pokročilého srdečního selhání
Chronické srdeční selhání (CHSS) je velmi časté postižení, jehož výskyt dále narůstá, v závislosti na rostoucí střední délce života a v důsledku lepšící se lékařské péče. U řady pacientů v pokročilejším stadiu CHSS dochází v důsledku základního onemocnění k rozvoji dilatace a dysfunkce srdečních oddílů a k manifestaci srdeční dyssynchronie mezi kontrakcí síní a komor, a zejména k dyssynchronii kontrakce mezi oběma komorami. Podstatou těchto poruch je prodloužení AV převodu a dále poškozené inter- nebo intraventrikulárního vedení vzruchu, která se mohou v různé míře navzájem kombinovat.
K úpravě této mechanické srdeční dyssynchronie se používá tzv. srdeční resynchronizační terapie (SRT), které je dosahováno pomocí biventrikulární kardiostimulace. Existuje dostatek údajů o tom, že tento způsob stimulace vede u většiny z těchto nemocných k poklesu plnícího tlaku levé komory a k vzestupu dP/dT. Důsledkem je vzestup systolického nebo pulzního tlaku a zvýšení srdečního indexu. Klinické zkušenosti z mnoha center a multicentrické nerandomizované i randomizované klinické studie prokázaly, že resynchronizační léčba přináší objektivní zlepšení stavu u většiny nemocných. Lze očekávat zlepšení alespoň o 1 třídu funkční klasifikace, zvýšení maximální spotřeby kyslíku a příznivé ovlivnění kvality života. Studie z poslední doby ukazují, že SRT zlepšuje i prognózu nemocných.
Na druhé straně je nutné přiznat, že u některých nemocných hemodynamický ani klinický přínos dokumentovat nelze. Proto začíná hrát stále důležitější roli identifikace pacientů, u kterých lze očekávat příznivé ovlivnění hemodynamiky a s tím související klinické zlepšení. V tomto směru hraje stále důležitější roli echokardiografie, zejména tkáňové dopplerovské vyšetření.
Paralelně se SRT se rozvíjí chirurgická léčba s revaskularizačními výkony nebo výkony na levé komoře, které mají za cíl upravit její velikost a tvar. Řada nemocných indikovaných ke kardiochirurgickým operacím trpí dyssynchronií. U těchto pacientů se nabízí jednak využití SRT v pooperačním období, nebo implantace levokomorové elektrody s jejím zaslepením v levé podklíčkové oblasti pro pozdější použití.
Vzhledem k rychlému rozmachu SRT jsme se rozhodli zorganizovat satelitní sympozium se společností Medtronic Czechia s.r.o. Hlavním cílem je zodpovědět některé otazníky okolo SRT.
doc. MUDr. Josef Kautzner, CSc, FESC
Klinika kardiologie IKEM, Praha
Funguje srdeční resynchronizační terapie z pohledu medicíny založené na důkazech?
M. Táborský, P. Neužil
Srdeční resynchronizační terapie (SRT) představuje novou léčebnou metodu, která zlepšuje hemodynamické parametry a symptomy u nemocných s pokročilým srdečním selháním a komorovou dyssynchronií [1,2]. Ta hraje důležitou úlohu v patofyziologii srdečního selhání, jak prokazují některé experimentální práce, které demonstrují regionální molekulární změny spojené s poruchou kontrakce myokardu [3]. Komorová dyssynchronie je v populaci nemocných se srdečním selháním nejčastěji způsobena blokádou levého raménka Tawarova (BLRT). BLRT - a velmi pravděpodobně i blokáda pravého raménka Tawarova ve spojení s levou přední hemiblokádou - mají za následek nehomogenní kontrakci levé komory s výskytem segmentů časné a pozdní kontrakce. Neefektivní práce levé komory vede k dalšímu poklesu její kontraktility a progresi mitrální regurgitace [4]. Výsledkem je snížení srdečního výdeje, narůstající dilatace levé komory a napětí v její stěně [5]. Výskyt LBBB v populaci nemocných s pokročilým srdečním selháním kolísá od 20-50 % [6] a představuje samostatný nezávislý rizikový faktor mortality [7].
Akutní hemodynamické studie prokázaly, že SRT může u nemocných s pokročilým srdečním selháním a přítomností dyssynchronie pozitivně ovlivnit hemodynamiku jak zlepšením mechanické synchronizace obou komor, tak optimalizací síňokomorové aktivace. V počátcích SRT koncem 90. let byl již z prvních registrů a výsledků nerandomizovaných studií zřejmý potenciál této léčebné metody. Správně provedená SRT vedla ke zlepšení třídy funkční klasifikace (NYHA), zlepšení tolerance zátěže při 5minutovém testu chůze, k příznivému ovlivnění systolické funkce levé komory a kvality života. Ukázalo se, že z uvedené léčby profitují jak nemocní s ischemickou chorobou srdeční, tak i pacienti s dilatační kardiomyopatií. Tyto výsledky byly později potvrzeny několika randomizovanými studiemi - jejich přehled je uveden v tab. 1. Zatím chybí dostatek přesvědčivých údajů o úloze SRT u pacientů s fibrilací síní, ale některá data nasvědčují tomu, že i u nich dochází k pozitivnímu ovlivnění tolerance zátěže a kvality života [8].
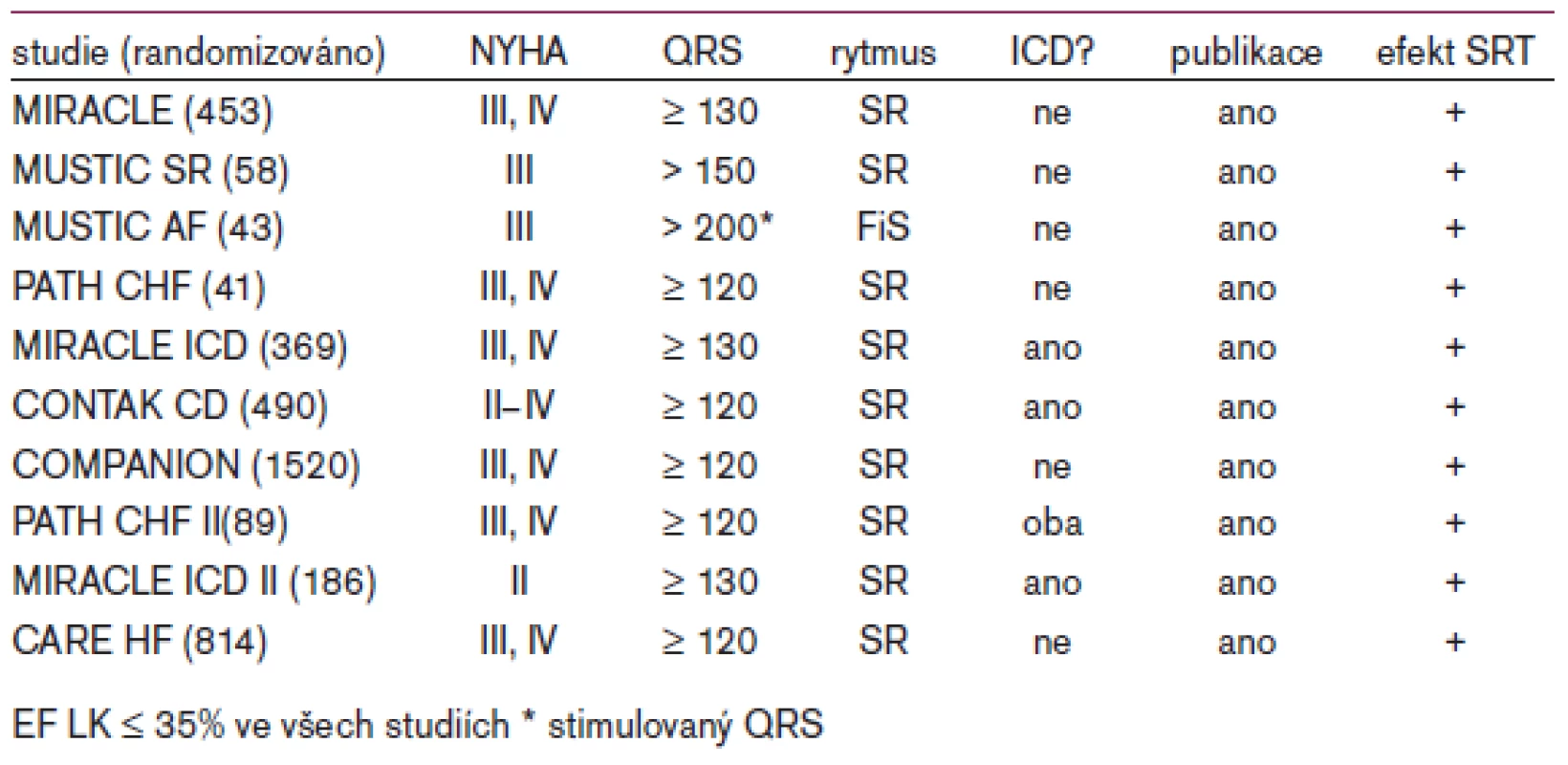
Zásadní otázkou až donedávna bylo, zda SRT ovlivňuje příznivě i mortalitu nemocných se srdečním selháním. Bradleyho metaanalýza existujících studií, která srovnávala výsledky léčby u 809 nemocných se SRT a 825 nemocných léčených farmakologicky, prokázala signifikantní pokles mortality na progresivní srdeční selhání o 51 % a snížení počtu hospitalizací o 29 %. Celková mortalita však statisticky významně ovlivněna nebyla [9]. Studie COMPANION (graf 1), která měla problematický kombinovaný primární endpoint (úmrtí nebo hospitalizace z jakýkoliv příčin), ukázala jeho významné ovlivnění v důsledku SRT nebo při spojení SRT s implantabilním kardioverterem-defibrilátorem. Celková mortalita byla sekundárním cílem studie a významného ovlivnění doznala pouze ve skupině léčené implantabilním kardioverterem-defibrilátorem s možností SRT. Znamená to tedy, že má mít každý nemocný s průkazem komorové dyssynchronie implantovaný kardioverter-defibrilátor? Zdá se, že rozhodně nikoliv! Recentně publikovaná studie CARE-HF prokázala ve střednědobém horizontu příznivé ovlivnění celkové mortality samotnou SRT [10]. Na druhé straně existují údaje pro populaci nemocných se srdečním selháním (NYHA II-IV) a bez závislosti na dyssynchroni, které ukazují na pokles mortality v důsledku samotné implantace kardioverteru-defibrilátoru (pouze back-up komorová stimulace 40/min) v porovnání s podáváním placeba nebo amiodaronu (studie SCD-Heft, graf 2).
SRT je ekonomicky náročnou léčbou. V současnosti však existuje řada studií, které prokázaly významné snížení počtu hospitalizací pro srdeční selhání v důsledku SRT. Příkladem může být studie z Karolinska Institut ze Švédska (graf 3), která uvádí, že 1 rok resynchronizační léčby vede k úspoře, která se prakticky rovná ceně implantátu [11].

Jaká je tedy strategie v indikaci resynchronizačních systémů (tj. kardiostimulátor vs implantabilní kardioverter-defibrilátor) pro blízkou budoucnost? Postup bude jistě ve většině případů individualizovaný. Vzhledem k tomu, že nemocní se srdečním selháním ve třídě NYHA II-III umírají nejčastěji náhlou srdeční smrtí, je tendence implantovat u této skupiny ICD. Nemocní s velmi pokročilým srdečním selháním umírají zejména na refrakterní srdeční selhání, a proto bude v těchto případech větší prostor pro samotný biventrikulární stimulátor (tab. 2). Nicméně je nutno konstatovat, že tato otázka zůstává stále nedořešena a je předmětem dalšího intenzivního výzkumu.
Závěrem je možno konstatovat, že dle současných poznatků je SRT skutečně léčbou založenou na důkazech z randomizovaných klinických studií, kde bylo prokázáno snížení mortality, snížení nákladů na léčbu a zlepšení kvality života. Z tohoto důvodu se tato léčba dostává ve všech inovovaných doporučení pro implantace kardiostimulátorů nebo implantabilních kardioverterů-defibrilátorů (ESC, Heart Rhythm Society, AHA, ACC) do indikační skupiny I s úrovní důkazů třídy A (tj. léčba s jednoznačně prokázaným efektem). Pro svoji ekonomickou výhodnost představuje SRT účinně vynaloženou investici v rámci prostředků všeobecného zdravotního pojištění.
Literatura:
1. Hare JM. Cardiac resynchronization therapy for heart failure. N Engl J Med 2002; 346: 1902-1905.
2. Abraham WT, Fischer WG, Smith AL et al. Cardiac resynchronization in chronic heart failure. N Engl J Med 2002; 346: 1845-1853.
3. Sprangg DD, Leclercq C, Loghmani M et al. Regional alterations in protein expression in the dyssynchronous failing heart. Circulation 2003; 108: 929-932.
4. Wyman BT, Hunter WC, Prinzen FW et al. Effects of single- and biventricular pacing on temporal and spatial dynamics of ventricular contraction. Am J Physiol Circ Physiol 2002 ;282: H372-379.
5. Leclercq C, Kass DA. Retiming the failing heart: priciples and current clinical status of cardiac resynchronization. J Am Coll Cardiol 2002; 39: 194-201.
6. Stewart S, Horowitz JD. Home-based intervention in congestive heart failure: long-term implications of readmission and survival. Circulation 2002; 105: 2861-2866.
7. Gottipady VK, Krelis S, Lu F et al. The resting electrogram provides a sensitive and inexpensive marker of prognosis in patients with chronic heart failure. J Am Coll Cardiol 1999; 145A.
8. Linde C, Leclercq C, Rex S et al. Long-term benefits of biventricular pacing in congestive heart failure: results from the MUltisite STimulation in cardiomyopathy (MUSTIC) study. J Am Coll Cardiol 2002; 40: 111-118.
9. Bradley DJ, Bradley EA, Baughman KL et al. Cardiac resynchronization and death from progressive heart failure. JAMA 2003; 289: 730-40.
10. Cleland GFJ, Daubert JC, Erdmann E et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352. www.nejm.org.
11. Braunschweig F. The cost analysis of resynchronization therapy. Eur J Heart Failure 2000; 2: 399-406.
MUDr. Miloš Táborský, CSc.,
MUDr. Petr Neužil, CSc.
Kardiologické oddělení Nemocnice Na Homolce, Praha
Jak vybrat kandidáty vhodné pro srdeční resynchronizační léčbu?
E. Mandysová
Srdeční resynchronizační terapie (SRT) je označením pro novou nefarmakologickou léčebnou metodu pokročilého srdečního selhání u nemocných s poruchou nitrokomorového vedení vzruchu a z toho vyplývající poruchou synchronizace kontrakcí srdečních komor. SRT eliminuje regionální zpoždění kontrakcí v oblasti levé komory, zlepšuje vzájemnou synchronicitu kontrakcí pravé i levé komory a obnovuje fyziologický vztah mezi kontrakcí levé síně a levé komory. Těmito mechanizmy ovlivňuje SRT bezprostředně [2] i v dlouhodobějším sledování [3] různé parametry srdeční funkce.
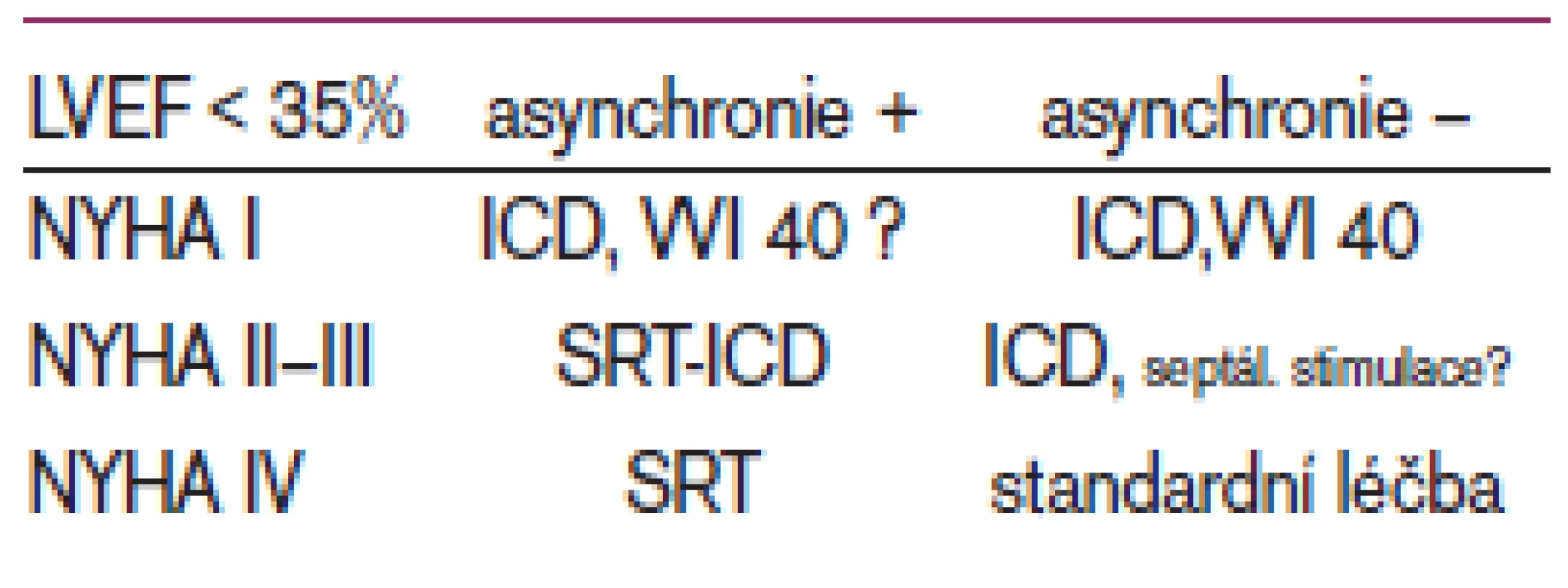
Na základě prvních zkušeností byli k SRT indikováni nemocní s medikamentózně refrakterním srdečním selháním NYHA III–IV, kteří měli rozšířený komplex QRS (> 130 ms) na EKG [1] a dilatovanou levou komoru s nízkou ejekční frakcí (≥ 35 %). Zjištění, že přibližně 1/4 nemocných po SRT nedosáhla očekávaného zlepšení, vedla ke studiu parametrů, které by lépe popsaly pacienty vhodné k této léčbě, tj. prokázaly asynchronii srdečních kontrakcí.
Echokardiografie jako metoda vizualizující kontrakci zde má nezastupitelnou roli. Klasická 2rozměrná echokardiografie pomáhá zjistit, zda pacient vyhovuje současně platným indikačním kritériím pro SRT (ejekční frakce, enddiastolický rozměr levé komory). Pulzní dopplerovskou echokardiografií se zjišťuje přítomnost interventrikulárního mechanického zpoždění, které se vypočte z rozdílu preeječních časů levé a pravé komory měřených v aortálním, resp. v pulmonálním ústí. Hodnoty vyšší než 40–60 ms svědčí pro interventrikulární asynchronii. Je možné také izolovaně hodnotit preejekční čas levé komory; hodnoty nad 140-160 ms svědčí znovu pro interventrikulární asynchronii.
Přítomnost intraventrikulární asynchronie je možné určit v parasternální krátké ose pomocí M-způsobu zobrazení. Hodnotí se zde mechanické zpoždění mezi septem a zadní stěnou levé komory (vzdálenost vrcholů kontrakce obou protilehlých stěn větší než 130 ms představuje intraventrikulární asynchronii). Tímto způsobem je možné určovat asynchronii kontrakcí v příčné ose, které však představují jen menší část celkové funkce levé komory.
Pro hodnocení intraventrikulární asynchronie je důležitější zjišťovat zpoždění kontrakcí v longitudinální ose levé komory, neboť longitudinální kontrakce u zdravého srdce představují až 70 % kontrakční schopnosti levé komory. Z echokardiografických metod je v současné době za nejvhodnější považována tkáňová dopplerovská echokardiografie - díky své schopnosti kvantifikovat směr i rychlost pohybu s vysokým časovým rozlišením. Časově slouží rychlostní křivky regionálních myokardiálních rychlostí k výpočtům různých parametrů popisujících stupeň asynchronie [4,5], např. časový interval mezi vrcholy křivek regionálních myokardiálních rychlostí získaných z protilehlých stěn levé komory slouží k průkazu intraventrikulárního mechanického zpoždění (obr. 1 a 2) i ke zhodnocení efektu resynchronizace. Zpoždění regionálních myokardiálních rychlostí dobře koreluje s elektrickou aktivací srdce, jak ukazují elektroanatomické mapy.


Testují se parametry odvozené z regionálních myokardiálních rychlostí, tzv. strain a strain rate. Jejich výhodou je, že nejsou ovlivňovány celkovým pohybem srdce ani pohybem okolních srdečních segmentů [6], jak tomu je v případě myokardiálních rychlostí. Rozvíjí se také metoda 3rozměrného zobrazení, které by mělo snadněji a přesněji kvantifikovat regionální asynchronii.
Tkáňová dopplerovská echokardiografie představuje oblast, které je v současné době věnována v echokardiografii největší výzkumná pozornost. Získané výzkumné poznatky jsou testovány v klinické praxi. Na obecně platná klinická doporučení si ale budeme muset ještě počkat, čemuž nasvědčuje i fakt, že průkaz intraventrikulární dyssynchronie zatím nepředstavuje samostatné indikační kritérium k resynchronizační léčbě.
Literatura:
1. Gottipaty V, Krelis S, Lu F et al. The resting electrocardiogram provides a sensitive and inexpensive marker of prognosis in patients with chronic congestive heart Failure. J Am Coll Cardiol 1999; 33(2): 145A.
2. Breithadt OA, Stellbrink Ch, Kramer AP et al. Echocardiographic quantification of left ventricular asynchrony predicts an acute hemodynamic benefit of cardiac resynchronization therapy. J Am Coll Cardiol 2002; 40: 536-45.
3. Abraham WT, et al. MIRACLE study group, Cardiac resynchronization in chronic heart failure. N Engl J Med 2002; 346: 1845-53.
4. Cho G-Y et al. Myocardial systolic synchrony measured by Doppler Tissue Imaging as a role of predictor of left ventricular ejection fraction. Improvement in severe congestive heart failure. J Am Soc Echocardiogr 2004; 17: 1245-50.
5. Pan C, Hoffmann R, Kühl H et al. Tissue tracking allows rapid and accurate visual evaluation of left ventricular function. Eur J Echocardiography 2001; 2: 197-202.
6. Breithardt OA. Cardiac resynchronization therapy can reverse abnormal myocardial strain distribution in patients with heart failure and left bundle branch block. J Am Coll Cardiol 2003; 42(3): 486-94.
MUDr. Eva Mandysová, CSc.
Kardiologické oddělení Nemocnice Na Homolce, Praha
Srdeční resynchronizační léčba sama o sobě nebo v kombinaci s kardiochirurgickým výkonem?
J. Kautzner
Léčba chronického srdečního selhání (CHSS) je předmětem zvýšeného zájmu lékařské veřejnosti, a to vzhledem k vysokému počtu postižených a výsledným socioekonomickým dopadům. Incidence CHSS se odhaduje v Evropě na 1,3 případů na 1000 jedinců nad 25 let věku a prevalence na 3,9 % [1,2]. Navzdory významnému pokroku v medikamentózní léčbě CHSS se neustále zvětšuje populace nemocných s významným omezením aktivit. Srdeční transplantace je řešením pouze pro malou část této populace. V tomto smyslu se rozvíjejí další nefarmakologické metody léčby CHSS. Jednou z nich je tzv. srdeční resynchronizační terapie (SRT). Jinou možností jsou chirurgické metody léčby, zaměřené především na úpravu tvaru a velikosti levé komory a zmírnění mitrální regurgitace. Existuje minimum údajů o možnosti kombinace obou metod.

Zatímco SRT je v současnosti rutinně používanou metodou, která ovlivňuje příznivě kvalitu života nemocných, počet hospitalizací a prognózu [3], chirurgická léčba CHSS se postupně rozvíjí. V současnosti existují 4 přístupy chirurgické léčby: a) revaskularizace myokardu, b) výkony na mitrální chlopni k redukci sekundární mitrální regurgitace, c) ventrikuloplastiky směřující k restauraci tvaru a velikosti levé komory, d) metody používající externí komprese k zabránění další dilatace levé komory (např. přípravky CorCap nebo Myosplint). Existuje řada důkazů o tom, že prognóza nemocných s CHSS se zhoršuje se stupněm postižení koronárních tepen a že revaskularizace myokardu zlepšuje prognózu těchto nemocných. Metaanalýza 24 klinických studií ukázala, že nejvíce profitují pacienti s prokázanou viabilitou myokardu (mortalita 3,2 vs 16 %, p < 0,0001) [4]. Výkony na mitrální chlopni (mitrální anuloplastika menším prstencem, případně plastika cípů chlopně) vedou u vybraných nemocných k výraznému funkčnímu zlepšení a pozitivnímu ovlivnění jejich prognózy (5leté přežití 50-75 %) [5]. Největší přínos byl dokumentován ve spojení s revaskularizací myokardu [6]. Restaurace velikosti a tvaru levé komory je dalším přístupem, který zásadně ovlivňuje kvalitu života i prognózu nemocných s CHSS [7,8]. Přestože tento výkon odstraňuje do jisté míry i komorovou dyssynchronii [7], nemocní s širokým komplexem QRS profitují méně než pacienti s komplexem štíhlým (tj. bez předpokládané dyssynchronie) [8]. První zkušenosti s přípravky zajišťujícími externí kompresi dilatované komory (například síťka CorCap) jsou také nadějné [9].


Vzhledem k tomu, že řada nemocných podstupujících kardiochirurgický výkon trpí současně dyssynchronií kontrakce komor, lze uvažovat o použití obou metod [10]. Jednou z možností je dočasná pooperační SRT u nemocných s vysokým rizikem (výrazná dilatace levé komory, blokáda levého raménka Tawarova nebo chronická kardiostimulace). Další alternativou je prospektivní umístění levokomorové elektrody v době kardiochirurgického výkonu u nemocných s dysfunkcí levé komory a její vyvedení do levé podklíčkové oblasti. První možnost byla poprvé testována u pacientů s dysfunkcí pravé komory, kteří podstupují operaci za účelem korekce vrozené srdeční vady [11] a existují první kazuistiky o jejím využití u pacientů s dysfunkcí levé komory (12). Druhá možnost se začíná postupně používat a zatím neexistují souborná data o jejím přínosu. Nicméně individuální případy nasvědčují oprávněnosti této strategie. Tento postup by měl umožnit operovat i více rizikové pacienty, kteří mají předoperačně dokumentovanou dyssynchronii.
Dosavadní vývoj nasvědčuje tomu, že bude docházet k rozšíření kardiochirurgické léčby u nemocných s CHSS. V tomto smyslu je potřeba vytvořit standardní protokol k vyšetření nemocných, kteří by mohli mít největší přínos ze současné SRT.
Literatura
1. Cowie MR, Wood DA, Coats AJS et al. Incidence and aetiology of heart failure. A population-based study. Eur Heart J 1999; 20: 421-428.
2. Mosterd A, Hoes AW, de Bruyne MC et al. Prevalence of heart failure and left ventricular dysfunction in general population. The Rotterdam Study. Eur Heart J 1999; 20: 447-455.
3. McAlister FA, Ezekowitz JA, Webe N et al. Sytematic review: Resynchronization in patients with symptomatic heart failure. Ann Intern Med 2004; 141: 381-390.
4. Allman KC, Shaw LJ, Hachamovitch R, Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary Artury disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol 2002; 39: 1151-1158.
5. Calafiore AM, Di Mauro M, Gallina S et al. Mitral valve surgery for chronic ischemic mitral regurgitation. Ann Thorac Surg 2004; 77: 1989-1997.
6. Bax JJ, Braun J, Somer ST et al. Restrictive annuloplasty and coronary revascularization in ischemic mitral regurgitation results in reverse left ventricular remodeling. Circulation 2004; 110(Suppl II): 103-108.
7. Di Donato M, Toso A, Dor V et al. Surgical ventricular restoration improves mechanical dyssynchrony in ischemic cardiomyopathy. Circulation 2004; 109: 2536-2543.
8. Lee R, Hoercher K, McCarthy PM. Ventricular reconstruction surgery for congestive heart failure. Cardiology 2004; 101: 61-71.
9. Douglas L. Clinical evaluation of the CorCap cardiac support device in patients with dilated cardiomyopathy. Presented at the AHA Scientific Sessions, November 7, 2004, New Orleans, USA. www.acorn.com.
10. Gaudiani VA. Biventricular pacing during cardiac operations. Heart Surg Forum 2003; 6: E126-E128.
11. Janoušek J, Vojtovič P, Hučín B et al. Resynchronization pacing is a useful adjunct to the management of acute heart failure after surgery for congenital heart defects. Am J Cardiol 2001; 88: 145-152.
12. Tanabe M, Onishi K, Kitamura T et al. Effective cardiac resynchronization after Dor procedure and mitral annuloplasty. Can J Cardiol 2004; 20: 449-451.
doc. MUDr. Josef Kautzner, CSc, FESC
Klinika kardiologie IKEM, Praha
Léčba dyslipidemie typické pro pacienty s metabolickým syndromem a DM 2. typu
V. Bláha
Patofyziologickým podkladem dyslipidemie metabolického syndromu(METS) a diabetické dyslipidemie je inzulinová rezistence. Na inzulin resistentní tukové buňky ve zvýšené míře uvolňují uložené triglyceridy, a proto dochází ke zvýšení koncentrace volných mastných kyselin v cirkulaci. Tento fenomén je společný pro obézní a neobézní pacienty s inzulinovou resistencí a diabetiky II. typu. Mastné kyseliny jsou ve zvýšené míře vychytávány játry, kde jsou z nich resyntetizovány triglyceridy, a po vazbě na apolipoprotein (apo) B uvolňovány do oběhu v podobě VLDL (very low density lipoprotein). Výsledným stavem je zvýšení počtu VLDL-částic a koncentrace triglyceridů v plazmě. Při současném zvýšení VLDL v plazmě a normální aktivitě plazmatického cholesterol-ester-transfer-proteinu (CETP) jsou VLDL-triglyceridy směňovány s HDL-cholesterolem. To znamená, že VLDL-partikule poskytne molekulu triglyceridů do HDL-částice, a naopak získá 1 molekulu cholesterol-esteru z HDL. Důsledkem těchto procesů je vznik a) cholesterolem obohacené VLDL-remnantních partikulí, které jsou více aterogenní, b) o triglyceridy obohacených a o cholesterol ochuzených HDL-částic. Triglyceridy bohaté na HDL-částice dále podléhají modifikaci včetně hydrolýzy triglyceridů, nejspíše jaterní lipázou, což vede k disociaci strukturálně důležitého proteinu apo A-I. Volný apo A-I v plazmě je odstraňován (zejména ledvinami) rychleji než apo A-I asociovaný s HDL-částicí. Proto dochází k redukci HDL-cholesterolemie. Dále vznikají malé denzní LDL-částice. Zvýšená koncentrace VLDL-triglyceridů v přítomnosti CETP podporuje výměnu triglyceridů do LDL za LDL-cholesteryl-ester. Na triglyceridy bohaté LDL podléhá hydrolýze jaterní lipázou nebo lipoproteinovou lipázou a vznikají “small, dense”, o cholesterol ochuzené a celkově o lipidovou komponentu ochuzené změněné LDL-částice.
Dylipidemie typická pro pacienty s metabolickým syndromem a DM 2. typu proto zahrnuje tzv. aterogenní triádu, tj. zvýšenou koncentraci triglyceridů, snížení HDL-cholesterolu a zvýšení malých denzních LDL. Tyto částice jsou potom více aterogenní, protože jsou náchylnější k oxidativní modifikaci a snáze penetrují endotelem tepenné stěny. Konformační změny apo B vedou potom ke snížení afinity LDL-částic k LDL-receptoru, a tudíž prodlužují jejich eliminaci. Hypertriglyceridemie je spojena s akumulací remnantních chylomikronů, které jsou aterogenní, a remnantních VLDL, které jsou také aterogenní. Hypertriglyceridemie generuje malé denzní LDL a vede ke snížení HDL, a je také spojena se zvýšenou koagulabilitou a sníženou fibrinolýzou v podobě zvýšení plazminogen-aktivátoru inhibitoru 1 (PAI-1) a faktoru VII a aktivaci protrombinu na trombin.
Léčebná strategie dyslipidemie typické pro pacienty s metabolickým syndromem a DM 2. typu. Léčba dyslipidemie musí probíhat současně se snahou podchytit a komplexně léčit všechny ostatní symptomy metabolického syndromu, které ovlivnit lze. Jedině taková důsledná léčba může vést ke snížení rizika angiopatických komplikací. Doporučení zdůrazňují individuální přístup. Kandidáty léčby jsou zejména nemocní s diagnózou ischemické choroby srdeční (ICHS) a se subklinickými formami ICHS. Základem hypolipidemické intervence u pacientů s dyslipidemií v rámci metabolického syndromu a DM 2. typu je dieta. Nezapomínáme na pohybový režim. Farmakoterapie dyslipidemií je vedená dle individuálního rizika a je určená pro jedince s vysokým rizikem. Hypolipidemická intervence je nesmírně důležitá. Studie UKPDS s diabetiky 2. typu (BMJ 1998; 316(7134): 823–828) zařadila lipidové rizikové faktory (zvýšení LDL, snížení HDL) mezi ty, které mají největší význam pro kardiovaskulární riziko. Kardiovaskulární mortalita je zvýšena i v rámci metabolického syndromu - RR (95% CI), 3,55 (1,98–6,43) [1]. Je prokázáno, že hypolipidemická léčba snižuje u pacientů s metabolickým syndromem a u diabetiků 2. typu kardiovaskulární riziko a incidenci fatálního i nefatálního infarktu myokardu [2,3]. Hypolipidemická intervence v těchto skupinách pacientů ovlivňuje také nonlipidové rizikové faktory (CRP, fibrinogen, TBARS, small dense LDL) [4].
Farmakoterapie dyslipidemie typické pro pacienty s metabolickým syndromem a DM 2. typu. Léky primární volby jsou fibráty a statiny samostatně či v kombinaci. Ve druhé linii se uplatňují sekvestranty žlučových kyselin, kyselina nikotinová či nově ezetimib (American Diabetes Association. Diabetes Care 2000; 23(Suppl 1): S57-S60). V rámci výběru farmaka a vedení léčby respektujeme bezpečnost, tolerabilitu event. cost-effectivness léčby. MONOTERAPIE má místo v léčbě aterogenní dyslipidemie. KOMBINACE farmak je indikována tehdy, pokud není dosažen cíl dle doporučení (NCEP III, ATP III). Možné kombinace zahrnují fibrát + statin, fibrát + niacin, fibrát + ezetimib, fibrát + glitazon + metformin, statin + niacin případně + ezetimib (obr. 1). Algoritmus léčby dyslipidemie pacientů s metabolickým syndromem a DM 2. typu shrnuje recentní slovenské doporučení (obr. 2) [5].


Poděkování:
Práce byla podpořena výzkumným záměrem MSM0021620820 a granty IGA MZ ČR č. NB/8497-3, NB/8062-3.
Literatura
1. Lakka HM et al. Kuopio Ischaemic Heart Disease Risk Factor Study. JAMA 2002; 288: 2709-2716.
2. Haffner SM. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. NEJM 1998; 339: 229-34).
3. Robins SJ et al. Diabetes, hyperinsulinemia and recurrent coronary events in the VA-High Density Lipoprotein Intervention Trial (VA-HIT). Circulation 2000; 102 (Suppl. II): 847.
4. (Melenovsky V, Malík J, Wichterle D, Šimek J, Pisařiková A, Škrha J, Poledne R, Stávek P, Češka R. American Heart Journal 1444,4,2002).
5.Tkáč I, Fábryová Ľ, Klimeš I et al. Manažment dyslipidémií u pacientov s diabetes mellitus. Vyjadrenie stanoviska Slovenskej diabetologickej spoločnosti. Diabetes Obez 2004; 4(7): 92-99.
Prof. MUDr. Vladimír Bláha, CSc.
Klinika gerontologická a metabolická, LF UK a FN Hradec Králové
Studie EVA (EValuation of Atherothrombosis)
Řada studií prokázala význam protidestičkové léčby v sekundární ale i primární prevenci u vysoce rizikových pacientů. Přestože je používání kyseliny acetylsalicylové (ASA) u nemocných s klinickou manifestací aterosklerózy široce rozšířeno, poměrně často dochází k rozvoji opakované aterotrombotické příhody. Jednou z možných příčin je aspirinová rezistence, která je literárně udávaná v 10–40 %. O aspirinové rezistenci lze hovořit buď z klinického pohledu – jako selhání protektivního účinku aspirinu před trombotickou komplikací, nebo ji lze definovat laboratorně – jako neschopnost způsobit prokazatelnou inhibici destičkových funkcí. Studie EVA měla přinést některé údaje týkající se této problematiky v České republice.
Cíl studie: Zjistit počet a poměr nemocných s anamnézou prodělaného infarktu myokardu (IM), ischemické cévní mozkové příhody (iCMP) nebo s ischemickou chorobou dolních končetin (ICHDK), kteří prodělali opakovanou ischemickou (aterotrombotickou) příhodu v době, kdy byli léčeni preparátem, obsahujícím kyselinu acetylsalicylovou (ASA). U těchto nemocných byl zhodnocen jejich profil z hlediska přítomnosti rizikových faktorů aterosklerózy.
Metoda: Otevřená observační studie provedená v ambulancích odborných lékařů – kardiologů, internistů, angiologů a neurologů. Do studie bylo zařazeno 4 454 pacientů, každý lékař zhodnotil celkem 50 po sobě jdoucích nemocných, kteří splňovali vstupní kritéria, tj. prodělali IM, iCMP, ICHDK. Z tohoto souboru bylo vybráno 1 263 nemocných, tj. 28,4 %, u kterých došlo k ischemické příhodě v době, kdy již byli léčeni ASA. U těchto bylo provedeno detailnější hodnocení. Sledovala se doba od vzniku ischemické příhody, rizikové faktory aterosklerózy a jejich medikamentózní léčba. Dále byla hodnocena dávka ASA v době stanovení diagnózy (< 75 mg, 75–165 mg, > 165 mg). Byl zhodnocen další postup antiagregační léčby u těch pacientů, kteří prodělali další ischemickou příhodu při léčbě ASA. Buď se pokračovalo v léčbě ASA ve stejné dávce, nebo se zvyšovala dávka ASA, nebo se pokračovalo ve stejné dávce v kombinaci s jinou léčbou, nebo se zvýšila dávka ASA a kombinovala s další léčbou, a konečně se ASA vysadila a nahradila jinou léčbou.
Výsledky: Do studie bylo zařazeno celkem 4 454 pacientů, kteří prodělali ischemickou příhodu. Z nich bylo pro další hodnocení vybráno 1 263 pacientů, kteří při léčbě ASA měli recidivu ischemické příhody. Nejčastěji se opakovala ischemická příhoda u pacientů s IM 67,8 %, CMP 50,6 %, ICHDK 32,4 %. Nejčastěji užívaná dávka ASA byla mezi 75–165 mg, a to u 85,7 % pacientů. Z rizikových faktorů byla nejčastěji přítomna hypertenze v 83 %, dyslipidemie v 72,3 %, DM v 41 %. Pacienti pokračovali v léčbě ASA ve stejné dávce v 22,7 %, ve zvýšené dávce ASA v 19,2 %, v 37,3 % pokračovali ve stejné dávce v kombinaci s jinou léčbou, ve zvýšené dávce ASA v kombinaci s jinou léčbou v 5,1 % a ASA byla vysazena a nahrazena jinou léčbou v 15,4 %.
Závěr: U nemocných s aterotrombotickou příhodou, kteří byli na dlouhodobé antiagregační terapii kyselinou acetylosalicylovou, dochází ke vzniku recidivy u 28,4 % pacientů. Pouze u 15,4 % pacientů dochází k vysazení terapie ASA a změně za jiný lék. Nejčastěji je dávka ASA ponechána a kombinována s jinou léčbou v 37,3 %.
doc. MUDr. Miroslav Souček, CSc.1,
prof. MUDr. Jiří Vítovec, CSc., FESC2
1II. interní klinika LF MU a FN U sv. Anny, Brno;
2I. interní kardioangiologická klinika LF MU a FN U sv. Anny, Brno
Moderní léčba akutních koronárních syndromů
Katetrizační intervence. Česká kardiologická společnost může být právem hrdá na to, že se stala (22. 5. 2002) první národní kardiologickou společností na světě, která oficiálně ve svých doporučených postupech pro léčbu akutního infarktu myokardu s elevacemi ST postavila primární perkutánní koronární intervenci (p-PCI) na první místo jako léčbu volby pro všechny nemocné, kteří se mohou dostat na katetrizační sál do 90 minut od stanovení diagnózy, a rovněž pro část nemocných s transportním časem na PCI delším než 90 minut (konkrétněji pro tu část, u nichž je stanovena diagnóza po uplynutí 3 hodin od začátku potíží). Trombolytická léčba tak zůstává rezervována pro relativně malou část nemocných, kteří přicházejí k lékaři včas (tj. do 3 hodin od začátku potíží) a u nichž není začátek PCI do 90 minut od stanovení diagnózy reálný. Teprve několik měsíců po ČKS přijala stejná doporučení i Evropská kardiologická společnost a dokonce až o 2 roky po nás obě americké kardiologické společnosti (ACC a AHA). Z řady studií (včetně českého projektu VINO) vyplývá, že i pro léčbu akutního infarktu myokardu bez elevací ST je nejlepší léčbou co nejčasnější koronarografie s navazující katetrizační revaskularizací (která je v této časné fázi preferována před chirurgickou revaskularizací). Lze tedy říci, že základem moderní léčby akutních koronárních syndromů je co nejrychlejší koronarografie a navazující PCI, kdykoli je technicky schůdná. Tento mechanický postup odstraňuje jak přítomný trombus (jeho fragmentací), tak i preexistující stenózy či jiné nerovnosti lumen, které ke vzniku trombu přispěly.
Antitrombotická medikace. Tyto invazivně kardiologické postupy si však nelze představit bez účinné antitrombotické léčby. Antitrombotická terapie má být zahájena okamžitě při prvním kontaktu lékaře s pacientem trpícím akutním koronárním syndromem (samozřejmě po spolehlivém stanovení této diagnózy na základě 12svodového EKG ev. u infarktu bez elevací též na základě pozitivních markerů nekrózy). Antitrombotická terapie má vrcholit na katetrizačním sále (zde se kromě níže uvedených léků používají též inhibitory destičkového receptoru GPIIb IIIa – integrilin a abciximab), a poté v mírnější formě pokračovat doživotně jako prevence recidiv. Jejich riziko je největší v následujících 12 měsících po příhodě. Je zcela nepochybné, že nemocný s akutním koronárním syndromem má okamžitě po stanovení diagnózy dostat kyselinu acetylsalicylovou (ASA) a heparin. Čím dál více se i do této velmi časné fáze prosazuje též klopidogrel ve vysycovací dávce 300–600 mg (ev. až 900 mg ?). Po PCI (v naprosté většině případů se stentem) má po dobu 6–12 měsíců pokračovat tzv. duální protidestičková terapie (ASA + klopidogrel). U nemocných, kteří dostali lékový stent, je duální protidestičková terapie po dobu minimálně 6 měsíců vitálně důležitá, neboť u nich v důsledku pozdější endotelizace stentu hrozí pozdní trombóza stentu i po několika měsících.
Závěr. Moderní terapie akutních koronárních syndromů je založena na kombinaci časné katetrizační intervence s účinnou kombinovanou protidestičkovou terapií. Dokáže tak významně snížit riziko úmrtí a recidivy infarktu proti dříve užívaným postupům.
prof. MUDr. Petr Widimský, DrSc.
Kardiocentrum 3. LF UK a FN Královské Vinohrady, Praha
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2005 Číslo 3
Nejčtenější v tomto čísle
- Lékové stenty – mechanizmy účinku a současné indikace
- Léčba hypertrofické kardiomyopatie
- Ramipril v klinických studiích
- Hypertenze a stárnoucí srdce z pohledu geriatra






