Katetrizační ablace fibrilace komor: realita nebo fikce?
Catheter ablation of ventricular fibrillation: reality or fiction?
Ventricular fibrillation (VF) is the most serious arrhythmia resulting in cardiac arrest. Implantation of cardioverter-defibrillator (ICD) is an effective therapy to prevent sudden cardiac death, however, does not eliminate recurrence of this arrhythmia and ICD discharges.
Despite accumulating evidence that mechanism responsible for VF perpetuation is reentry, recent studies have shown that VF can be initiated by premature ventricular contractions originating from the distal Purkinje system. Catheter ablation of such triggers can eliminate recurrence of VF.
Key words:
ventricular fibrillation - premature ventricular contractions - catheter ablation
Autoři:
H. Mlčochová; J. Kautzner; P. Peichl; J. Bytešník
Působiště autorů:
Klinika kardiologie IKEM, Praha
Vyšlo v časopise:
Kardiol Rev Int Med 2006, 8(Supplementum): 43-46
Souhrn
Fibrilace komor (FK) je nejzávažnější formou arytmie, jejímž důsledkem je oběhová zástava. Implantace kardioverteru-defibrilátoru (ICD) sice zabrání riziku náhlé arytmické smrti, není však léčbou kauzální. Neovlivní proto recidivy této arytmie a výboje ICD. Rovněž omezený je efekt antiarytmické medikace.
Přestože mechanizmus odpovědný za udržení FK je reentry, recentní studie prokázaly, že tato arytmie může být spouštěna komorovými extrasystolami vycházejícími převážně z Purkyňova systému. Katetrizační ablace této komorové ektopie je schopna eliminovat recidivy FK.
Klíčová slova:
fibrilace komor - komorové extrasystoly - katetrizační ablace
Úvod
Fibrilace komor (FK) je nejzávažnější formou arytmie, která je spojena s oběhovou zástavou. Pokud není okamžitě řešena defibrilací, vede v několika minutách k nezvratnému poškození mozku a k úmrtí. V současné době je u pacientů, kteří měli dokumentovánu maligní formu arytmie, metodou volby implantace kardioverteru-defibrilátoru (ICD). Nejedná se však o léčbu kauzální. Většina pacientů je nadále sužována opakovanými výboji ICD a kvalita života bývá často výrazně snížena.
Mapování během FK prokázalo, že mechanizmem arytmie je reentry, při níž se elektrická aktivita šíří v proměnlivých reentry okruzích nebo spirálách. Recentní studie však potvrdily, že podobně jako fibrilace síní může být FK spouštěna z fokálních zdrojů. Obvykle jde o ložisko mající původ v distálním Purkyňově systému, které produkuje komorové extrasystoly (KES) o krátkém vazebném intervalu. Ty mohou spustit polymorfní komorovou tachykardii nebo FK. Z toho vyplývá, že katetrizační ablace má potenciál eliminovat recidivy FK. Cílem tohoto přehledu je přiblížit danou problematiku.
Idiopatická fibrilace komor
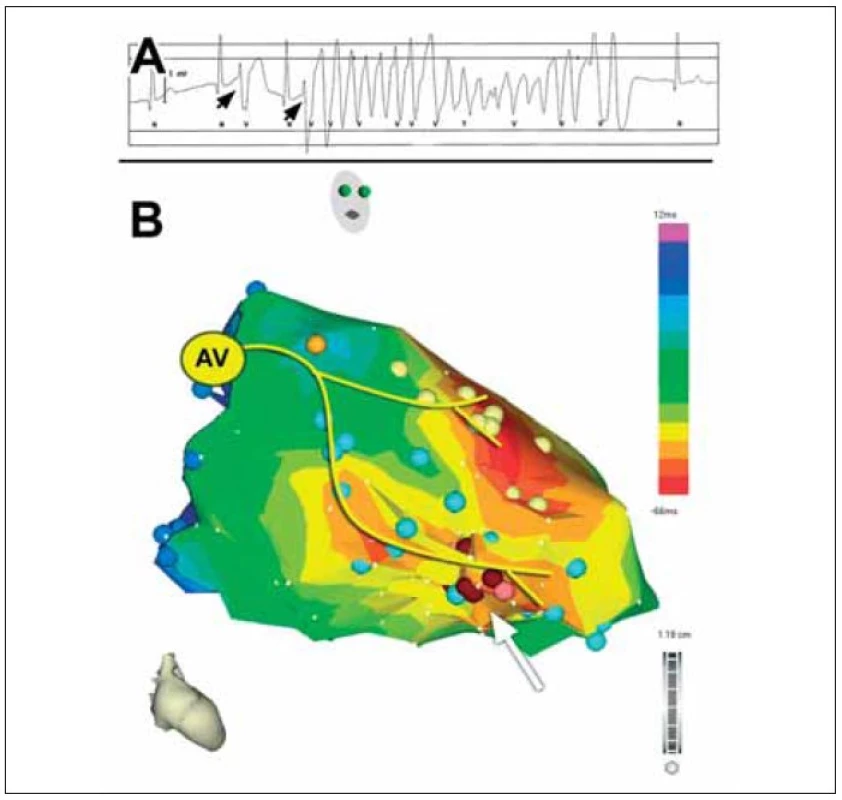
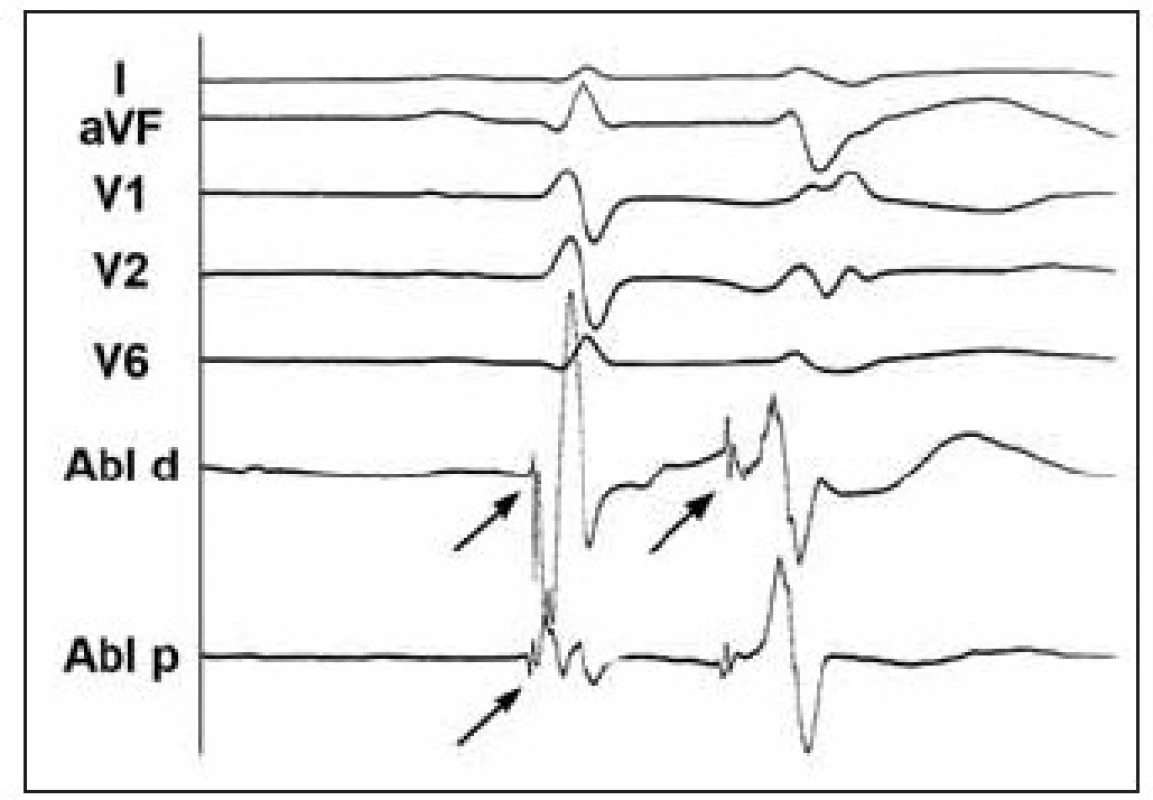
V roce 2000 popsali Kautzner et al kazuistiku pacienta s idiopatickou formou polymorfních komorových tachykardií (KT) [1]. Jednalo se o 26letého nemocného bez organického srdečního onemocnění s četnými polymorfními KT a indukovatelnou FK při elektrofyziologickém vyšetření. Po implantaci ICD měl nemocný četné adekvátní výboje, které vedly během několika let k druhé výměně přístroje. Ta byla provázena arytmickou bouří, při níž byly na EKG dokumentovány monomorfní KES s krátkým vazebným intervalem (240 ms) a morfologií tvaru blokády pravého raménka Tawarova se sklonem osy doleva. Tyto KES spouštěly četné běhy polymorfní KT někdy degenerující do FK (obr. 1A). Následně bylo provedeno mapování v levé komoře, které prokázalo přítomnost arytmogenního fokusu v distální části převodního systému v oblasti zadního fasciklu levého raménka Tawarova (obr. 1B). Během mapování byl zaznamenán časný potenciál s nízkou amplitudou a vysokou frekvencí, který předcházel KES o 60-80 ms a sinusový stah o cca 10-15 ms (obr. 2). Po aplikaci radiofrekvenčního proudu tento potenciál i komorová ektopie vymizely a pacient je dlouhodobě bez recidiv maligních KT a bez výbojů ICD.
Tato práce vyvolala diskusi a spustila pátrání po podobných případech v jiných centrech. Výsledkem byla kolaborativní studie 6 center, jejíž výsledky byly zveřejněny v roce 2002 Haïssaguerrem et al [2,3]. U souboru 16 a posléze 27 nemocných s idiopatickou FK spouštěnou KES byl mapován zdroj. KES spouštějící FK měly identickou morfologii a vazebný interval k předcházejícímu QRS (297 ± 41 ms) jako izolované KES. Při elektrofyziologickém vyšetření byla lokalizována nejčasnější aktivita této trigrující komorové extrasystoly a následně provedena RF- ablace. KES spouštějící FK vycházely převážně z oblasti Purkyňových vláken převodního systému (20 případů) a v menším počtu z oblasti výtokového traktu pravé komory.
KES byly předcházeny vysokofrekvenčním potenciálem z Purkyňových vláken (PP) o nízké amplitudě s průměrným vazebným intervalem k předchozímu QRS 38 ± 28 ms. Delší vazebný interval byl zaznamenán u KES vycházející z LK proti PK (46 ± 29 ms vs 19 ± 10 ms). Vazebný interval byl z toho u 10 nemocných proměnlivý v čase a pohyboval se od 20-150 ms při KES. Během sinusového rytmu však vazebný interval stabilně předcházel QRS o 11 ± 5 ms. V místě nejčasnější aktivace komor při KES byla provedena aplikace radiofrekvenční energie, která u všech nemocných vedla k přechodné exacerbaci arytmie a 1krát byla indukována FK s nutností defibrilace. Posléze došlo k vymizení KES. U 2 nemocných došlo k časné recidivě KES avšak s jinou morfologií a tyto byly v obou případech úspěšně odstraněny pakováním ablace v jiném místě Purkyňova systému. U 3 nemocných bez spontánní komorové ektopie byla ablace provedena pomocí techniky pacemappingu během sinusového rytmu.
Během následujícího sledování (24 ± 28 měsíců) nebyla zaznamenána náhlá smrt, synkopa či recidiva FK u 24 nemocných (89 %). Pozdní recidivy shodné komorové ektopie jako před ablací měli 3 nemocní a ti obdrželi antiarytmickou medikaci, z nich 2 pacienti zaznamenali výboj ICD pro FK a 1 měl spontánně končící epizodu presynkopy při 6sekundovém běhu polymorfní KT.
Tato kolaborativní práce poprvé prokázala, že v případech dokumentovaného spouštění FK ektopickými stahy (obvykle z Purkyňových vláken), lze ablací ektopického fokusu ve většině případů dosáhnout úspěšné eliminace této maligní arytmie. V souboru těchto pacientů dokonce neměli 4 implantován ICD (ani 1 z nich nepatřil do skupiny s recidivou arytmie) a po prodloužené době monitorace během hospitalizace byli dále léčeni jen konzervativně. Poprvé tak byla rozpoznána možná role převodního systému při spouštění FK.
Fibrilace komor spojená s LQTS nebo Brugadovým syndromem
U skupiny nemocných bez strukturálního srdečního onemocnění jako je Brugadův syndrom nebo syndrom dlouhého intervalu QT (LQTS) jsou klinickým projevem recidivy polymorfních KT, které někdy přecházejí do FK. Haïssaguerre et al [4] prezentoval v roce 2003 soubor 7 nemocných (4 s LQTS a 3 s Brugadovým syndromem), u kterých byly dokumentovány četné epizody KT a FK spouštěné monomorfními ektopickými komorovými stahy. KES, které spouštěly FK, vycházely opět buď z převodního systému nebo z oblasti výtokového traktu pravé komory (3 případy). Tito nemocní rovněž podstoupili RF-ablaci v místě nejčasnější aktivace KES. Během následného sledování po dobu 17 ± 17 měsíců nebyla ani u 1 z nich dokumentována recidiva arytmií. Tato práce prokázala, že i u pacientů s vrozenými poruchami iontových kanálů může při spouštění maligní arytmie hrát důležitou úlohu spouštěcí fokus, který může být opět lokalizován v převodním systému a jeho eliminací lze výskyt arytmií potlačit.
Arytmická bouře na podkladě recidivující FK časně po akutním infarktu myokardu
Arytmická bouře časně po akutním infarktu myokardu (AIM) je sice vzácnou, ale zato velmi vážnou komplikací. Bänsch et al [5] zveřejnili v roce 2003 výsledek 3letého sledování u souboru 4 nemocných s dysfunkcí LK časně po AIM (2 AIM přední a 2 AIM spodní stěny), u kterých se vyvinula arytmická bouře na podkladě recidivujících běhů FK i při medikaci betablokátory, amiodaronem a lidokainem. Všichni tito nemocní podstoupili předtím úspěšnou perkutánní nebo chirurgickou revaskularizaci myokardu (v rozmezí 5 hodin až 4 dnů od počátku symptomů). I přes provedenou léčbu se u těchto nemocných objevovaly četné epizody FK a KT. Všechny tyto arytmie byly spouštěny monomorfní komorovou ektopií s obrazem blokády pravého raménka Tawarova. Po opakované koronarografii, která vyloučila případnou reokluzi v místě intervence na věnčitých tepnách, bylo rozhodnuto o provedení endokardiálního mapování s cílem radiofrekvenční ablace KES, které iniciovaly běhy maligních komorových tachyarytmií.
Elektrofyziologickým mapováním byla zjištěna při KES nejčasnější aktivace v anteroseptální (1 nemocný) a inferoseptální (2 nemocní) oblasti. Každá KES byla opět předcházena zřetelným vysokofrekvenčním Purkyňovým potenciálem o nízké amplitudě, který předcházel začátek QRS-komplexu o 126 až 160 ms. V daných lokalizacích se uvedený potenciál vyskytoval i během sinusového rytmu (23 až 26 ms před QRS). U 1 nemocného nebyla během mapování přítomna spontánní komorová ektopie, a proto byla k lokalizaci arytmogenního fokusu použita technika pace mappingu. Po 6-30 aplikacích radiofrekvenční energie došlo k vymizení všech lokálních Purkyňových potenciálů v místě nejčasnější aktivace (příp. v místě nejlepší shody klinických KES s pace mappingem) a k eliminaci komorové ektopie. V průběhu dalšího sledování 33, 14, 6 a 5 měsíců po RF-ablaci nebyla ani v 1 případě zaznamenána recidiva komorové arytmie.
Patofyziologickým podkladem uvedených arytmií je v tomto případě zřejmě porucha funkce buněk převodního systému, které pro svoji větší odolnost přežívají v oblasti akutní nekrózy. Tato hypotéza má experimentální oporu v pracích Friedmana et al [6,7]. Tito autoři již v roce 1973 na psím modelu prokázali, že buňky Purkyňových vláken jsou daleko odolnější proti případnému ischemickému poškození myokardu a přežívají s dočasně porušenou funkcí. Pravděpodobně se na tom podílí i možnost výživy těchto buněk formou difuze subendokardiálně.Toto pozorování by mohlo vysvětlit, proč u nemocných po proběhlé koronární příhodě dochází v převodním systému k vzniku KES spouštějících FK.
Arytmická bouře na podkladě recidivující fibrilace komor u chronické ischemické kardiomyopatie
V následujícím roce publikovala skupina z Clevelandu [8] další kolaborativní práci týkající se souboru 29 nemocných s chronickou ischemickou chorobou a poinfarktovou dysfunkcí levé komory, u nichž se objevila arytmická bouře. Z těchto případů bylo 8 rezistentních k antiarytmické medikaci, a proto u nich bylo indikováno podrobné endokardiální mapování s cílem případné ablace arytmogenního substrátu. Během mapování byla u 5 nemocných s četnou monomorfní komorovou ektopií detekována při KES nejčasnější aktivace na rozhraní mezi jizevnatou a zdravou tkání myokardu levé komory. Také v této oblasti byl detektován vysokofrekvenční potenciál analogický potenciálu Purkyňových vláken u pacientů s idiopatickou FK. Tento potenciál předcházel lokální aktivaci myokardu komor během sinusového rytmu i během ektopie spouštějící FK průměrně o 195 ± 45 ms. Ve 3 případech, v nichž nebyla během mapování přítomna ektopická aktivita, byla za místo ablace vybrána oblast s přítomnými potenciály na hranici jizvy a zdravé tkáně. Katetrizační ablace vedla u všech nemocných k vymizení lokálních Purkyňových potenciálů i komorové ektopie. Během následného sledování po dobu 10 ± 6 měsíců nedošlo ani u 1 nemocného k recidivě arytmické bouře, pouze v 1 případě byla dokumentována recidiva FK a 1krát setrvalá monomorfní KT. Tato studie dokumentovala, že Purkyňova vlákna přežívající v místě nekrózy myokardu mohou být zdrojem ektopické aktivity i dlouho po zhojení AIM. I v těchto případech lze spouštěcí fokus odstranit úspěšně pomocí katetrizační ablace.
Arytmická bouře u nemocných s ostatními kardiálními patologiemi
Arytmická bouře je spojena často i s jinou formou kardiální patologie [9,10]. V literatuře byla například popsána kazuistika 17letého muže po náhradě aortální chlopně s dilatací (56mm) a dysfunkcí levé komory (ejekční frakce 35 %), který měl po operaci četné epizody FK spouštěné opakovaně KES dvou morfologií. Během mapování byla lokalizována místa nejčasnější aktivace při KES a následně provedena úspěšná radiofrekvenční ablace obou arytmogenních fokusů [9].
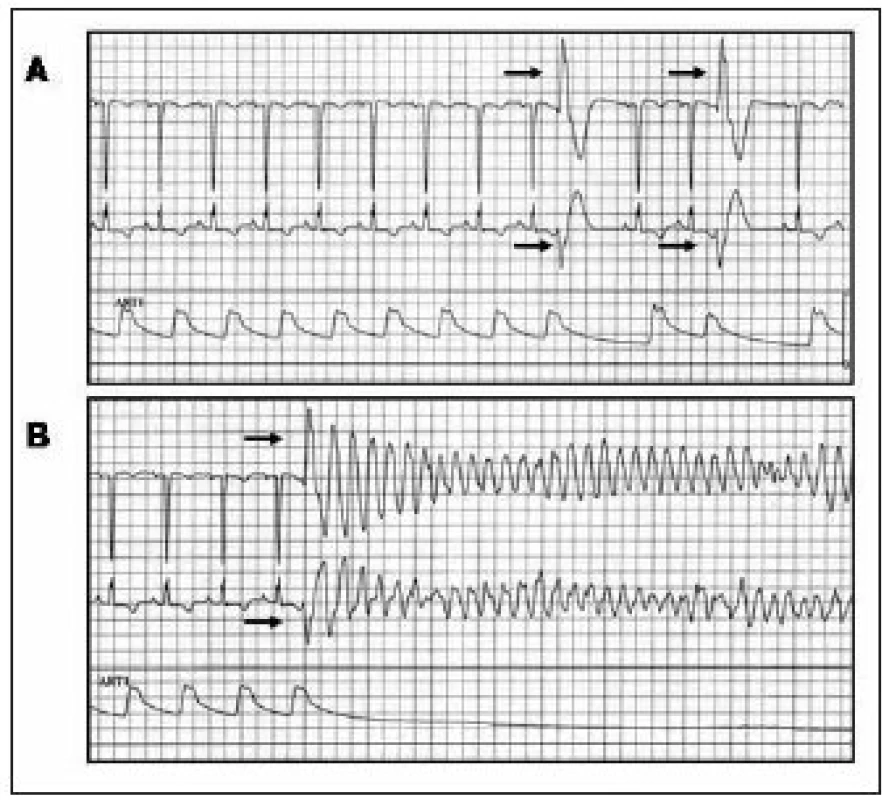
V Clevelandu [10] byla provedena úspěšná katetrizační ablace spouštěcího fokusu pro FK u 2 pacientů s následně biopticky prokázanou srdeční amyloidózou. V obou případech spouštěly monotopní KES arytmickou bouři, kterou nebylo možno ovlivnit antiarytmickou medikací. Spouštěcí KES měly morfologii blokády pravého raménka Tawarova (obr. 3) a vycházely u jednoho pacienta z proximálního svazečku levého raménka Tawarova a u druhého pacienta z apikolaterální oblasti LK. Lokální signál měl opět charakter svědčící pro původ ektopie v převodním systému. Po aplikaci radiofrekvenční energie do místa nejčasnější aktivace při KES došlo k vymizení komorové ektopie a nemocní byli dále bez recidiv maligních KT.
Tyto práce dokumentují, že i u nemocných s jinými kardiopatiemi může hrát převodní systém důležitou roli při spouštění polymorfní KT nebo FK.
Závěry
Závěrem lze konstatovat, že katetrizační ablace může být v některých případech kauzální léčbou FK, a nejde tedy o léčebnou strategii z oblasti science fiction. Vzhledem k maligní povaze FK však zatím zůstává u této skupiny pacientů implantace ICD stále nedílnou součástí spolehlivého zajištění před náhlou smrtí. Na druhé straně je zřejmé, že katetrizační ablace fokálních spouštěčů pro FK může vést k částečné nebo úplné eliminaci recidiv maligních arytmií, a tím k výraznému zlepšení kvality života. V případech arytmických bouří může být dokonce život zachraňujícím výkonem. Proto je důležité v takových případech dokumentovat na EKG výskyt KES a jejich úlohu při iniciaci FK. Nemocní, u kterých je FK spouštěna komorovou ektopií, by měli být okamžitě přeloženi do elektrofyziologického centra, kde je možné provést akutní ablační výkon.
MUDr. Hanka Mlčochová
prof. MUDr. Josef Kautzner, CSc., FESC
MUDr. Petr Peichl
MUDr. Jan Bytešník, CSc.
Klinika kardiologie IKEM, Praha
MUDr. Hanka Mlčochová (1976)
Promovala na 1. LF UK v Praze (2001). Působí na Klinice kardiologie IKEM v Praze (od r. 2001). Jako první autorka již publikovala ve dvou impaktovaných zahraničních časopisech. V roce 2005 byla na vědecké stáži v Cleveland Clinic Foundation (Department of Cardiovascular Medicine).
Zdroje
1. Kautzner J, Bytešník J. Catheter ablation of arrhythmogenic focus in short-coupled variant of Torsade de Pointes. PACE 2000; 23: 717.
2. Haïssaguerre M, Shah DC, Jais P et al. Role of Purkinje conducting system in triggering of idiopathic ventricular fibrillation. Lancet 2002; 359: 677-678.
3. Haïssaguerre M, Shoda M, Jais P et al. Mapping and ablation of idiopathic ventricular fibrillation. Circulation 2002; 106: 962-967.
4. Haïssaguerre M, Extramiana F, Hocini M et al. Mapping and ablation of ventricular fibrillation associated with long-QT and Brugada syndromes. Circulation 2003; 108: 925-928.
5. Bänsch D, Oyang F, Antz M et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation 2003; 108: 3011-3016.
6. Friedman PL, Stewart JR, Fenoglio JJ Jr, Wit AL. Survival of subendocardial Purkinje fibers after extensive myocardial infarction in dogs. Circ Res 1973; 33(5): 597-611.
7. Friedman PL, Stewart JR, Wit AL. Spontaneous and induced cardiac arrhythmias in subendocardial Purkinje fibers surviving extensive myocardial infarction in dogs. Circ Res 1973; 33(5): 612-26.
8. Marrouche NF, Verma A, Wazni O et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. J Am Coll Cardiol 2004; 43: 1715-1720.
9. Li YG, Gronefeld G, Israel C, Hohnloser SH. Catheter ablation of frequently recurring ventricular fibrillation in a patient after aortic valve repair. J Cardiovasc Electrophysiol 2004; 15: 90-93.
10. Mlčochová H, Saliba W, Burkhardt D et al. Catheter ablation of ventricular fibrillation storm in patients with infiltrative amyloidosis of the heart. J Cardiovasc Electrophysiol. Published online November 23, 2005. doi: 10.1111/j.1540-8167.2005.00321. www.blackwell-
-synergy.com
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2006 Číslo Supplementum
Nejčtenější v tomto čísle
- Katetrizační ablace atrioventrikulární nodální reentry tachykardie: léčba první volby?
- Katetrizační léčba typického flutteru síní včera a dnes
- Katetrizační ablace akcesorních spojek: vyřešená otázka?
- Neselektivní ablace AV-uzlu: nové aspekty v době kurativní léčby fibrilace síní a srdeční resynchronizační terapie

