Tenektepláza v současné klinické praxi
Tenecteplase in current clinical practice
Tenecteplase is the third generation thrombolytic agent produced by genetic engineering by mutation of the classical Plasminogen Activator (tPA) and with the main aim to increase resistence against natural Plasminogen Activator Inhibitor (PAI‑ l) and prolongation of its biological halftime. Tenecteplase is fibrin‑specific and, as its substantial advantage, its halftime allows IV administration by single bolus. Recently, it has become the trombolytic agent of the first choice in the developed countries for the treatment of acute myocardial infarction (AMI) with ST‑segment elevation (STEMI) and its properties predestine it to be an ideal drug for pre‑hospital treatment. At present, a large international multicentric study STREAM is under way to evaluate its benefits in the early stage of AIM over direct coronary angioplasty. It has been used with favourable results in other acute clinical indications, such as a pulmonary embolism and arterial and venous closure. However, no randomized trials have been conducted so far in these indications. The possibility of its application in acute ischemic stroke is being verified, the small randomized studies performed so far have provided favourable results.
Keys words:
tenecteplase – acute myocardial infarction – pre‑hospital treatment – acute pulmonary embolism –
acute vessel closure – acute ischemic stroke
Autoři:
S. Janoušek
Působiště autorů:
Interní kardiologická klinika, FN Brno‑Bohunice
Vyšlo v časopise:
Kardiol Rev Int Med 2010, 12(1): 46-53
Souhrn
Tenektepláza je trombolytikem třetí generace vyrobené genetickým inženýrstvím jako mutant klasického aktivátoru plazminogenu (tPA) s hlavním cílem zvýšené rezistence proti přirozenému inhibitoru aktivátoru plazminogenu (PAI‑ l) a prodloužení biologického poločasu. Je fibrin specifická a její poločas umožňuje i.v. aplikaci formou jediného bolusu, což je její velkou předností. V současnosti se stala trombolytikem první volby ve vyspělých zemích pro léčbu akutního infarktu myokardu (AIM) s elevacemi ST (STEMI) a její vlastnosti ji předurčují do role ideálního léku pro přednemocniční léčbu. Nyní probíhá rozsáhlá mezinárodní multicentrická studie STREAM, která by měla vyjasnit, zda je v této indikaci v časném stadiu AIM přínosem i oproti direktní koroární angioplastice. Byla s příznivým výsledkem použita i v dalších akutních klinických indikacích, jako je plicní embolie a tepenné i žilní uzávěry, ale zatím v tomto směru nebyla provedena žádná randomizovaná studie. Ověřuje se možnost jejího podávání u akutních ischemických mozkových příhod, dosavadní menší randomizované studie byly příznivé.
Klíčová slova:
tenektepláza – akutní infarkt myokardu – přednemocniční léčba – akutní plicní embolie – akutní cévní
uzávěry – akutní mozkové ischemické příhody
Úvod
Trombolytika jsou léky užívané k léčbě stavů způsobených patologickým výskytem trombů, jako jsou akutní infarkt myokardu, akutní plicní embolie, akutní embolizace do periferních tepen, hluboká žilní trombóza, trombóza v centralis latinae, trombóza umělé chlopní náhrady apod. Tyto léky prodělaly v posledních desetiletích výrazný rozvoj od streptokinázy jako prvního trombolytika získaného z mukopolysacharidových obalů streptokoků [1], až po nejmodernější léky vyvíjené genetickým inženýrstvím. Trombolytika jsou vesměs exogenními aktivátory plazminogenu. Lze je rozdělit buď podle časového vývoje a obecných charakteristik tradičně na trombolytika první, druhé, třetí generace (tab. 1), nebo podle působení na fibrin‑nespecifická a fibrin‑ specifická trombolytika. Mezi fibrin‑nespecifická trombolytika patří streptokináza, anistreptáza (anisoylated plazminogen streptokinase activator complex – APSAC) a dvouřetězcová urokináza. Na plazmin konvertuje jak cirkulující, tak v trombech vázaný plazminogen. Za normálních okolností α2 antiplazmin inhibuje cirkulující plazmin, jehož plazmatická koncentrace je zhruba poloviční než plazminogenu. Fibrin‑nespecifická trombolytika indukují extenzivní tvorbu plazminu, což vede k vyčerpání zásob α2 antitrombinu, a tím ke zrušení jeho inhibičního efektu. Plazmin následně degraduje fibrinogen, koagulační faktory V, VII a XII a von Willebrandův faktor. Tato fibrinolýza podaná systémově vede ke snížení hladin cirkulujícího fibrinogenu až na 20 % a k recipročnímu zvýšení cirkulujících fibrin‑degradačních produktů [2].

Fibrin‑specifická trombolytika (tkáňový aktivátor plazminogenu – tPA – a od něj odvozená retepláza, tenektepláza a lanotepláza, dalšími jsou prourokináza a stafylokináza) aktivují jen plazminogen vázaný na trombus. Důsledkem je fibrinolýza především na povrchu sraženiny a menší efekt na volně cirkulující fibrinogen a z toho vyplývající jeho podstatně méně výrazný pokles.
Starší typy fibrinolytik mají celou řadu nevýhod. Fibrinolytika 1. generace nejsou selektivní k fibrinu a vedou k depleci fibrinogenu i plazminogenu. Úbytek plazminogenu v místě trombu (tzv. plazminogenový „steal efekt“) má za důsledek snížení lytického účinku. Podání streptokinázy nebo anistreplázy navíc vede ke tvorbě protilátek nebo jejich účinek je oslabený protilátkami po v minulosti prodělané streptokokové infekci. Avšak ani fibrinolytika 2. generace nejsou zcela fibrin selektivní. Jejich krátký plazmatický poločas navíc komplikuje aplikaci a vede k nutnosti podávat je v infuzní formě.
Z těchto důvodů byla v posledních letech vyvinuta řada dalších látek s cílem zlepšit farmakokinetické vlastnosti, dosáhnout vyšší fibrinolytické účinnosti, menší rezistence vůči inhibitorům a vysoké fibrinové specificity při zachování, nebo dokonce zlepšení bezpečnosti,
zejména z hlediska krvácení do mozku.
Fibrinolytika 3. generace jsou konstruována cílenými modifi kacemi přirozených aktivátorů humánního či bakteriálního nebo živočišného původu nebo se jedná o hybridní látky vzniklé spojováním částí různých molekul.
Vývoj fi brinolytik se nezastavil na III. generaci, je ověřována celá řada dalších látek [3– 4], ale podrobný rozbor této problematiky překračuje rámec tohoto sdělení, které je plně věnováno tenektepláze (TNK) jako nadějnému a celosvětově užívanému modernímu trombolytiku III. generace.
Chemické složení a základní farmakokinetika, srovnání s tPa
TNK byla vyvinuta cílenými modifi kacemi molekuly alteplázy (tPA) a má molekulární váhu 65 000 kD. Liší se od molekuly tPA šesti bodovými mutacemi (obr. 1). Substituce treoninu asparaginem v pozici 103 a mutace sekvence lysin‑histamin‑arginin‑arginin na sekvenci alanin‑alanin‑alanin‑alanin (pozice 296– 299) prodlužuje bio logický poločas a zvyšuje rezistenci k inhibitoru 1 aktivátoru plazminogenu (PAI‑1), substituce asparaginu (pozice 117) glutaminem vede k osminásobnému snížení clearance a velmi výrazné zvyšuje rezistenci k PAI‑1. Ve srovnání s dalšími molekulami užívanými v klinické praxi má TNK nejvyšší stupeň fibrinové specifi ty a vazby. Lytická aktivita je omezena na plazmin na povrchu fi brinu, takže se vyhýbá účasti fi brinogenu a faktoru V a faktoru VIII do koagulace [5]. Konfi rmační změny TNK redukují její eliminaci a prodlužují plazmatický poločas (11– 20 min oproti 4– 8 min u tPA). Nitráty neovlivňují koncentraci TNK na rozdíl od tPA [6] a inhibice prostřednictvím PAI‑1 je 80krát redukovaná ve srovnání s alteplázou. Tyto vlastnosti umožňují léčbu jedním bolusem a jsou prevencí inaktivace léku v místě koronární trombózy s nadbytkem destiček. Navíc TNK má mnohem intenzivnější protidestičkové vlastnosti jak in vivo, tak in vitro ve srovnání s alteplázou [7]. V experimentálních modelech je trombolytická schopnost TNK výrazně vyšší než účinek alteplázy [8– 10]. Je zajímavé, že klinické studie u AIM takový výrazný rozdíl nepotvrdily, jak bude probíráno níže.
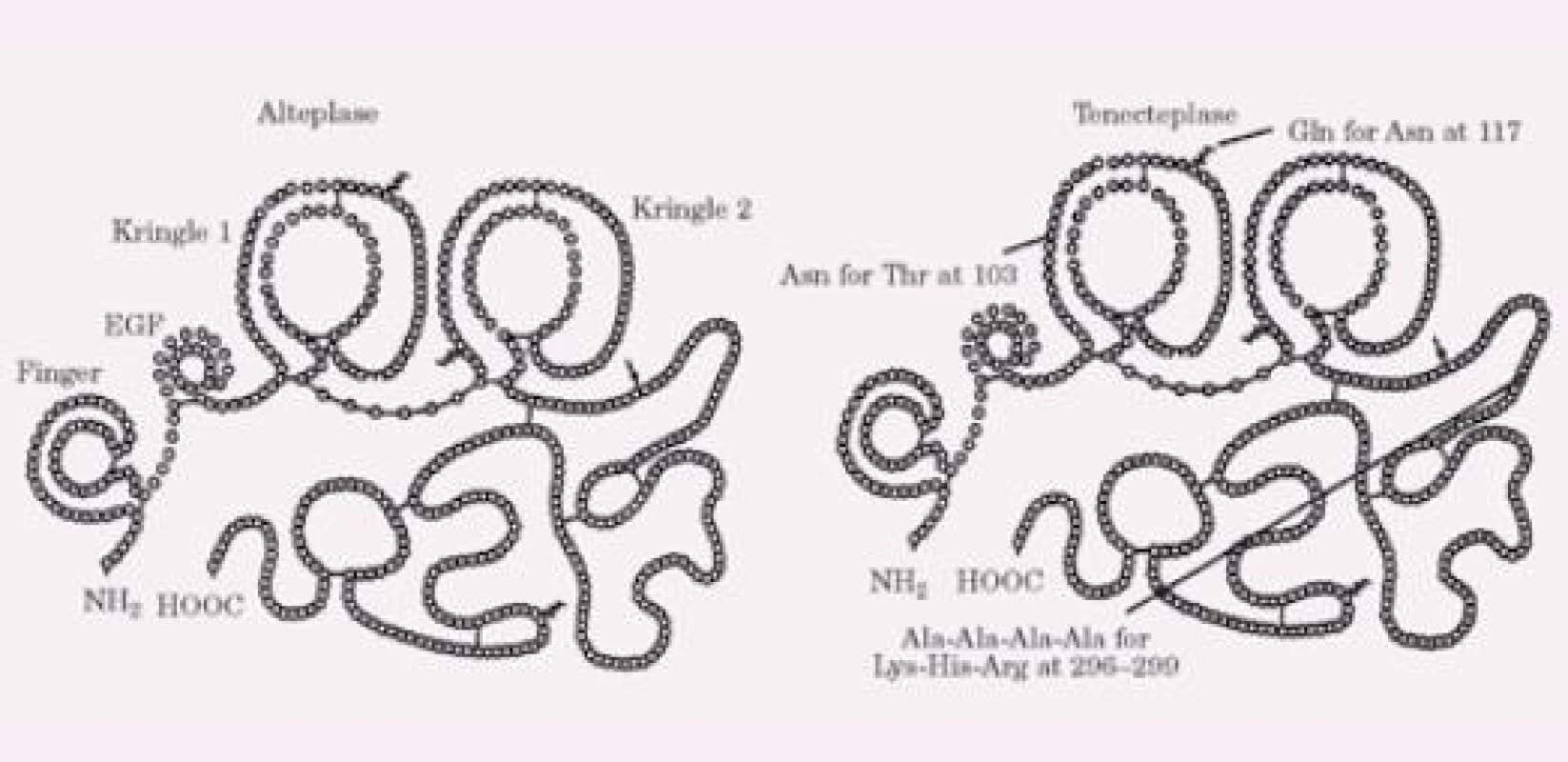
Významné je, že při podání TNK dochází k podstatně menší redukci plazmatického fi brinogenu než u tPA [11– 12].
Zajímavou otázkou je, jak vlastně přišla TNK ke svému jménu. Bylo odvozeno z anglosaských jednopísmenových zkratek pro nahrazené aminokyseliny u tPA (T pro treonin, N pro asparagin a K pro lysin). Proto byla nejprve nazvána „T, N and K mutant of tPA“, a z toho bylo vytvořeno pojmenování tenektepláza (anglicky tenecteplase).
Léčebné indikace k podání TNk
Akutní infarkt myokardu
AIM je onemocněním, u něhož časnost otevření trombotickým uzávěrem postižené tepny limituje rozvoj nekrotického ložiska, a proto se zde podání TNK ve formě bolusu přímo nabízí.
První klinické zkušenosti s podáním TNK u STEMI proběhly ve studii TIMI‑ 10A, která prokázala se zvyšováním dávky TNK (od 5 mg do 50 mg) i přímo úměrné zvýšení podílu kompletního otevření „infarktové“ tepny (tzv. TIMI‑ FLOW 3) [11].
Následovala pilotní studie TIMI 10B, která se zabývala průchodností v závislosti na zvyšující se dávce TNK. Zahrnula 886 pacientů. Injekce bolusu TNK dosáhla TIMI‑ FLOW 3 u 55 %, 63 a 60 % po 90 min při dávkách 30, 40 a 50 mg TNK [12]. TIMI‑ FLOW 3 byl obdobný v kontrolní skupině, která byla léčena akcelerovaným podáním tPA.
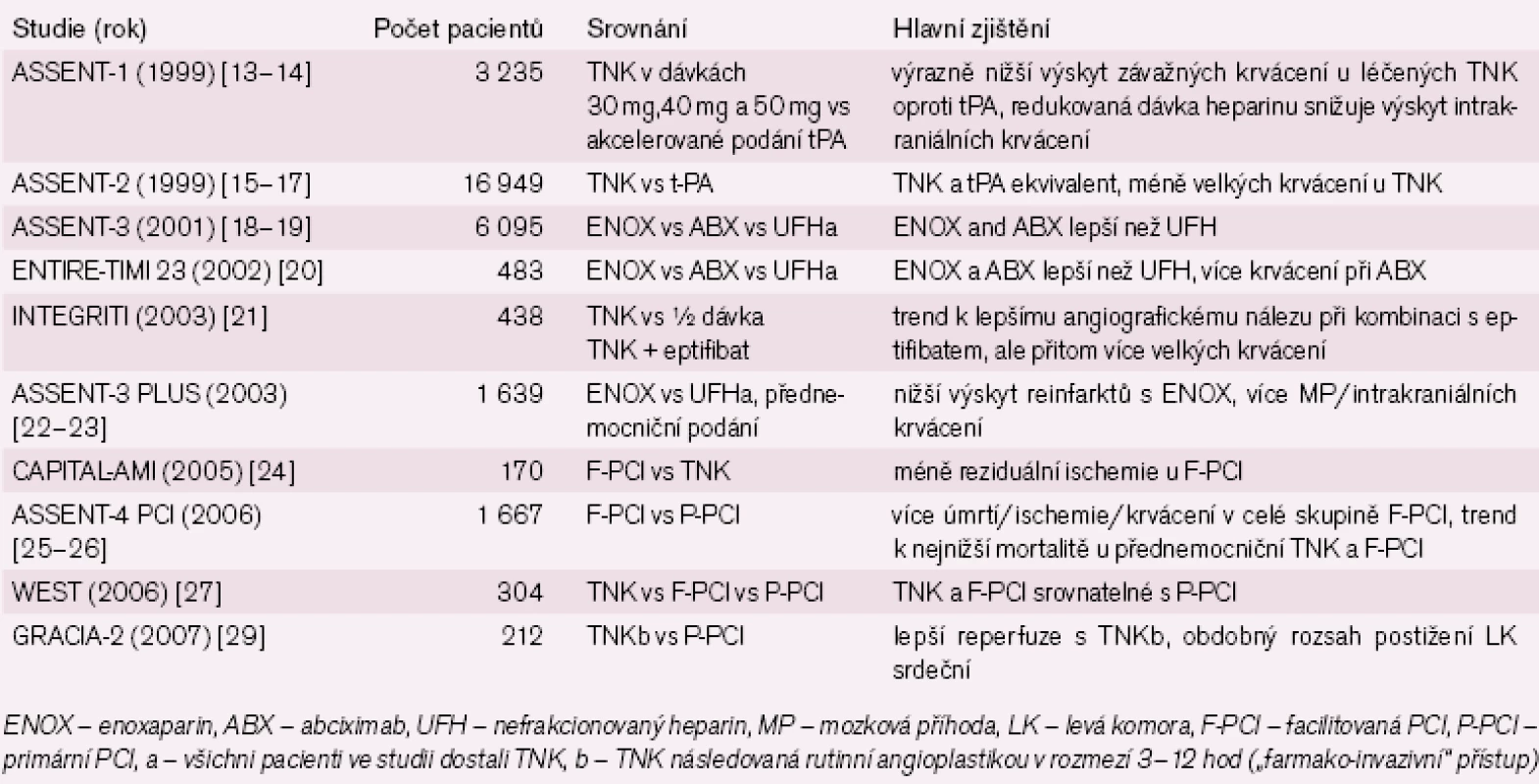
Stručný přehled dalších významných klinických randomizovaných studií s aplikací TNK u STEMI je v tab. 2.
Detailní pozornost si zaslouží poslední randomizované studie ASSENT 4‑ PCI, WEST a GRACIA 2 jejichž výsledky podstatně ovlivňují současnou klinickou praxi (Guidelines) léčby STEMI.
Nadějné výsledky studií ASSENT‑ 2, ASSENT‑ 3 a CAPITAL‑ AMI byly podnětem k zorganizování rozsáhlé studie ASSENT‑ 4 PCI [25]. Ta měla vyřešit otázku, zda by aplikace TNK 1– 3 před angioplastikou mohla zlepšit prognózu pacientů. Jednalo se o otevřenou studii a primární endpoint byl složen z mortality, srdečního selhání a kardiogenního šoku během 90 dní. Pouze 1 667 z plánovaných 4 000 nemocných bylo zařazeno, neboť studie byla předčasně ukončena, když byl zjištěn nárůst nemocniční mortality u nemocných, kde byla primární PCI facilitována TNK (6,0 % vs 3,8 %, p = 0,041) (tab. 3). TIMI‑ FLOW 3 byl dosažen před PCI u 43 % nemocných léčených TNK, ale jen u 15 % kontrolní skupiny (p < 0,001). Primární endpoint v 90 dnech byl zvýšený ve facilitované skupině (19 % vs 13 %, p = 0,0045), jakož i frekvence mozkových příhod (1,8 % vs 0, p < 0,0001). Tyto neuspokojivé výsledky byly retrospektivně přičítány možnému protrombotickému efektu trombolytické léčby a především zvýšenému riziku krvácení do ateroskletického plátu při inflaci balonku během prvních dvou hodin po trombolýze. Retrospektivní analýza ukázala, že riziko mortality v 90 dnech bylo redukováno při facilitaci TNK, když nemocní byli randomizováni přednemocničně v terénu (relativní riziko 0,74, 95% CI, 0,24– 2,30), avšak výrazně narůstalo, když byli pacienti randomizováni v nemocnicích s dostupností primární angioplastiky (relativní riziko 1,62, 95% CI, 0,94– 2,81). Jako zajímavost lze uvést, že nejpříznivější výsledky po stránce mortality byly zaznamenány u přednemocničně léčených TNK ve Francii (2,0 % vs 4,7 %), ale tento rozdíl nebyl vzhledem k menšímu počtu nemocných v této podskupině statisticky významný.
![30denní mortalita ve studii ASSENT 4 – PCI [26].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/b3edfc89f22c5d2d8cba6bd5b34b1014.png)
Studie byla kritizována, že se nesoustředila především na nemocné s možností přednemocniční léčby, neboť 45 % nemocných bylo do studie zařazeno v nemocnicích s dostupností PCI, a naopak přednemocničně léčených bylo ve studii pouze 19,5 %. Dalším závažným nedostatkem bylo, že nemocným nebyl rutinně podáván clopidogrel, i když je ze studie CLARITY známo, že jeho podání při trombolýze výrazně zlepšuje prognózu nemocných [31] i při následné angioplastice [32]. To zjevně znevýhodnilo skupinu léčenou TN a facilitovanou PCI. A konečně určitým metodickým nedostatkem bylo, že studie nebyla zaslepená. Kromě již výše uvedeného trendu k nejnižší mortalitě u přednemocničně léčených kombinací TNK a facilitované PCI poněkud unikl pozornosti fakt, že obdobný příznivý trend byl po analýze zjištěn u všech nemocných léčených do tří hodin od vzniku AIM [26].
Další studii vyšetřující význam facilitace prostřednictvím TNK byla studie WEST [27]. Randomizovaná otevřená studie sledovala 304 nemocných ze STEMI (40 % bylo zařazeno přednemocničně). Všichni pacienti dostávali kyselinu acetylsalicylovou a enoxaparin a byli randomizováni buď k podání TNK nebo TNK následovanou PCI během 24 hod (včetně rescue PCI pro reperfuzní selhání) nebo přímo k primární PCI. Čas od počátku symptomů k randomizaci byl 113, 130 a 176 min. Nebyly zjištěny žádné rozdíly mezi těmito skupinami v primárním kompozitním endpointu spočívajícím v mortalitě, reinfarktu, refrakterní ischemii srdečním selhání a komorových arytmií (25 % vs 24 % vs 23 %, p = NS). Studie WEST jen potvrdila předchozí data ze známé studie CAPTIM [28] ukazující, že výsledky při podání TNK jsou srovnatelné s primární PCI, a to může nabídnout velmi jednoduchou a efektivní léčbu, zvláště když je následná PCI provedena u nemocných s rekurentní ischemií nebo klinicky vysoce rizikových.
Multicentrická studie GRACIA 2 se zabývala podáním TNK u STEMI následované časnou rutinní PCI (během 3– 12 hod). Tento tzv. farmako‑invazivní přístup byl porovnáván s primární PCI u 212 pacientů zahrnutých do studie [29]. Primárním endpointem byla epikardiální a myokardiální reperfuze a rozsah poškození levé komory hodnocený prostřednictvím velikosti infarktu a funkce levé komory. Kompletní normalizace ST‑elevací na EKG křivce byla pozorována častěji u nemocných léčených TNK (61 % vs 43 %, p = 0,01), z toho vyplývala zlepšená myokardiální perfuze měřená jako TIMI flow stupeň v 60. minutě [30]. Velikost infarktu a funkce levé komory byly v obou skupinách obdobné. Můžeme shrnout, že výsledky studie WEST byly potvrzeny ve studii GRACIA 2 ukazující na srovnatelný výsledek léčby TNK (+ rescue/ rutinní PCI) s primární PCI. Nejvýznamnější pro klinickou praxi byl nález, že rutinní PCI po podání TNK může být odložena s benefitem o 3– 12 hod.
Snahou o reálné zhodnocení možného přínosu trombolytické léčby STEMI prostřednictvím TNK v časném stadiu onemocnění je v současnosti probíhající studie STREAM [33] (tab. 4), která by se měla vyvarovat výše uvedených nedostatků ASSENT‑ 4 PCI. Ne zcela dostatečná adjuvantní léčba je nahrazena povinným podáním clopidogrelu i v trombolytické větvi. Časná PCI je zde zvažována lékařem po 90 min od aplikace TNK a měla by být především z „rescue“ indikace, jinak standardně po 6– 24 hod po podání TNK. Tato studie by měla jasně zodpovědět otázku, zda může být kombinace obou léčebných metod přínosem pro nemocné se STEMI léčené časně po AIM.
![30denní mortalita ve studii ASSENT 4 – PCI [26].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/52e40314a69392739ebdcd43f06c89b3.png)
Sami jsme úspěšně na území Jihomoravského kraje vyzkoušeli ve spolupráci se Záchrannou zdravotní službou přednemocniční podání TNK u nemocných do 75 let věku se STEMI do dvou hodin po vzniku onemocnění [34], kde všichni nemocní kromě IV Heparinu a kyseliny acetylasalicylové dostávali PO 300 mg clopidogrelu. I když u všech nemocných byla provedena po příjezdu do katetrizačního centra okamžitá PCI, u nikoho nedošlo k časné retrombóze ani k závažnému krvácení a 30denní mortalita takto léčených byla nulová.
Na závěr článku lze shrnout, že léčbě STEMI prostřednictvím TNK bylo věnováno mnoho rozsáhlých multicentrických randomizovaných studií, které se zabývaly podrobně všemi základními problémy (srovnání s jinými trombolytiky, výběru nejlepší podpůrné a antitrombotické léčby a optimálnímu léčebnému postupu po podání TNK jakož i srovnání a vztahu k PCI atd.). Tyto práce se staly podkladem toho, že The American College of Chest Physicians (ACCP) uznala TNK jako třídu 1A doporučení v léčbě STEMI u nemocných do 12 hod po začátku potíží [35]. Podání TNK je nyní zahrnuto v mnoha přednemocničních trombolytických reperfuzních protokolech, jako je Vienna STEMI Registry [36], The Mayo Clinic STEMI Protocol [37] a The French FAST‑MI registry [38] a nepřímo i v doporučení léčby STEMI na Slovensku [39] a příznivě je zmíněno i v současných Guidelines ESC [40].
Přednemocniční podání TNK u STEMI je příležitostí nabídnout včasnou reperfuzi co největšímu počtu pacientů jednoduchým způsobem, základními přednostmi jsou snadný způsob podání, vysoký stupeň dosažení průchodnosti postižené tepny se sníženým rizikem velkého krvácení a příznivé výsledky srovnatelné během prvních 2– 3 hod nemoci s primární PCI. Výše zmíněná studie STREAM by měla vyjasnit, zda by kombinace obou těchto metod (tzv. farmako‑ invazivní přístup) za určitých podmínek mohla být dalším přínosem ke zlepšení prognózy nemocných v časném stadiu STEMI.
V tab. 5 jsou vyjádřeny základní doporučení k dávkování TNK a heparinu vyplývající z výše uvedených klinických studií.
![Schéma studie STREAM (Strategic Reperfusion Early After Myocardial Infarction) [33].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/6c85983d10c240b040b9cbb475e37dd7.png)
Přednemocniční podání TNK u STEMI je příležitostí nabídnout včasnou reperfuzi co největšímu počtu pacientů jednoduchým způsobem. Základními přednostmi jsou snadný způsob podání, vysoký stupeň dosažení průchodnosti postižené tepny se sníženým rizikem velkého krvácení a příznivé výsledky, srovnatelné během prvních dvou až tří hodin nemoci s primární PCI. Výše zmíněná studie STREAM by měla vyjasnit, zda by kombinace obou těchto metod (tzv. farmako‑invazivní přístup) za určitých podmínek mohla být dalším přínosem ke zlepšení prognózy nemocných v časném stadiu STEMI.
Akutní plicní embolie
Akutní plicní embolie (PE) je závažným onemocněním s relativně vysokou mortalitou. Trombolytická léčba je základním léčebným postupem u život ohrožujících akutních PE.
Je známo, že úmrtnost na akutní plicní embolii (PE) je největší v prvních dvou hodinách po jejím vzniku [41], a proto je velmi pravděpodobné, že trombolytika vyšší generace (jako jsou TNK a retepláza) jsou v této indikaci velmi nadějnými léky, vzhledem k možnosti jejich podání v bolusové formě a z toho vyplývajícího urychleného nástupu účinku. Zatím ale byla provedena pouze jedna menší randomizovaná studie srovnávající reteplázu s tPA [42]. Dosavadní sporadické zkušenosti s TNK v léčbě akutní PE jsou zatím příznivé [43– 49]. Zajímavá je kazuistika [50] popisující nemocného s masivní PE a srdeční zástavou, u něhož po bolusovém podání TNK pokračovala léčba bez komplikací klasickou infuzí tPA při současné léčebné hypotermii. Analýza několika kazuistik [51] shledává příznivý efekt léčby bolusem TNK bez závažných hemoragických komplikací. Panuje shoda, že by bylo žádoucí ověřit takovou léčbu závažné PE v randomizované studii [45,47,51]. Musíme si ale uvědomit, že na rozdíl od AIM je podstatně obtížnější provést takovou studii vzhledem k problémům se získáním dostatečného počtu nemocných, aby výsledky mohly být statisticky průkazné. V první fázi lze proto uvažovat jen o ověření příznivého efektu TNK pouhým zhodnocením ovlivnění funkce pravé komory, respektive plicní hemodynamiky [52].
V tomto kontextu je někdy zmiňovaná studie TROICA [53] jako příklad selhání léčby PE prostřednictvím TNK. Tu však nelze považovat za studii léčby akutní PE, protože byla zaměřena na nemocné s protrahovanou resuscitací bez jasného klinického průkazu akutní PE.
Periferní akutní arteriální uzávěr
Je závažným onemocněním ohrožujícím pacienty obvykle ztrátou části nebo i celé postižené končetiny. TNK zde byla zatím užívaná sporadicky [54– 55], ale bylo úspěšně provedeno i několik menších studií [56– 58]. S úspěchem byla v této indikaci vyzkoušena i kombinace TNK s eptifibatem při katetrové aplikaci bez vývoje závažných krvácivých komplikací [57].
I když podání TNK mělo v této indikci nadějné výsledky a nebyly zaznamenány častější významné krvácivé komplikace, léčba obvykle kromě úvodního bolusu vyžadovala i následnou kontinuální infuzi, což významně nivelizovalo její hlavní benefit oproti standardní infuzní léčbě tPA. To je asi také hlavní příčinou, proč zatím nedošlo v této indikaci k většímu rozšíření léčby prostřednictvím TNK.
Hluboká žilní trombóza
Hluboká žilní trombóza (HŽT) především v ileofemorální lokalizaci představuje závažné onemocnění vyžadující okamžitou léčebnou intervenci.
I zde bylo provedeno s TNK několik menších úspěšných studií bez závažných krvácivých komplikací s dávkováním obdobným jako při léčbě akutních tepenných uzávěrů [57– 58]. U ileofemorální trombózy byla s úspěchem použita i lokální pulzní sprejová katetrová trombolýza prostřednictvím TNK [59]. Také byla s úspěchem vyzkoušena kombinace TNK s eptifibatem [57] i kombinace TNK s mechanickou trombektomií [60]. Zajímavá byla multicentrická studie, která úspěšně ověřila akceleraci trombolytické léčby HŽT ultrazvukem, přičemž jedním z užitých trombolytik byla i TNK [61]. Aplikace ultrazvuku vedla k rychlejšímu a dokonalejšímu zprůchodnění žilního uzávěru i redukci závažných krvácení.
U HŽT platí obecně totéž, co již bylo uvedeno u akutních tepenných uzávěrů.
Léčba kromě úvodního bolusu vyžaduje následné podání TNK v kontinuální infuzi, což eliminuje hlavní výhodu podání TNK oproti terapii tPA, a proto asi zatím léčba prostřednictvím TNK v této indikaci nedosáhla většího rozšíření.
Ischemické mozkové příhody
Reperfuzní terapie akutních ischemických mozkových příhod (IMP) je v současnosti jejich nejefektivnější léčbou. Obnovení krevního průtoku do ohrožené tkáně před vznikem infarktu redukuje velikost infarktu a zlepšuje klinické výsledky. Během posledního desetiletí se rozvoj reperfuzní terapie stal prokázanou léčebnou strategií u akutní IMP potvrzenou daty z výzkumu i klinických studií a ukazující dramatický benefit časné mozkové reperfuze [62] prostřednictvím intravenózní trombolytické léčby během prvních tří hodin od vzniku příznaků. V pilotní studii National Institute of Neurological Disorders and Stroke se ukázalo, že zhruba každý třetí pacient z této léčby profitoval, vyjádřeno přesně z každé tisícovky léčených u 323 pacientů byl zjištěn příznivý efekt [63]. Nicméně standardně prováděná reperfuzní strategie (řízená podle CT do tří hodin od vzniku příznaků a prostřednictvím intravenózní tPA) má mnoho omezení, jako je krátké léčebné okénko, dosažení rekanalizace v méně než 50 % (kompletní dokonce v méně než 20 %) a podstatné riziko tzv. hemoragické transformace. To jsou asi jedny z hlavních důvodů, proč v současné klinické praxi nejsou takto zatím léčena více než 3 % pacientů.
V současnosti probíhá řada dalších klinických studií, které se snaží tato ne zcela nepříznivá čísla zlepšit, a to především prodloužením terapeutického období na delší dobu než dosavadní tři hodiny. Jednou ze zkoumaných cest je použití nových trombolytik 3. generace, mezi než patří i tenektepláza [64], která má celou řadu výhodných vlastností oproti tPA, jako je delší poločas umožňující jednobolusové podání, vysoká fibrinová specifita vedoucí k rychlejší a kompletnější lýze trombu s menšími krvácivými komplikacemi, menší systémová aktivace plazminogenu a chybění prokoagulačního efektu, což může redukovat časné reokluze.
Zavedení léčby akutních IMP prostřednictvím TNK bylo silně motivováno příznivými výsledky laboratorních výsledků léčby IMP na králičích modelech [65– 67].
V pilotní studii se zvyšováním dávky bylo 75 nemocných s ischemickou mozkovou příhodou (IMP) léčeno intravenózní TNK během tří hodin od počátku potíží [68]. Byly podávány tři dávky TNK: 0,1, 0,2 a 0,4 mg/ kg. Nebyl pozorován žádný symptomatický případ nitromozkového krvácení během 72 hod po léčbě, ale nebyl také ani pozorován žádný vztah mezi dávkou a neurologickým zlepšením během prvních 24 hod.
V současnosti je TNK ověřována pro léčbu akutní IMP ve dvou rozsáhlejších randomizovaných studiích. Studie TNK‑ S2B (Study of Tenecteplase (TNK) in Acute Ischemic Stroke (SPOTRIAS) [69] byla zahájena v listopadu 2005 s cílem zahrnutí 600 nemocných s akutní IMP třemi rozdílnými dávkami tenekteplázy a kontrolní skupinou léčenou tPA během prvních 3 hod IMP. Dále probíhá multicentrická randomizovaná mezinárodní studie Tenecteplase For Ischemic Lacunar Stroke s jedním bolusem TNK 0,1 mg/ kg IV u nemocných do 6 hod od vývoje progrese příznaků mozkové příhody a do 24 hod od vzniku prvních příznaků [70].
Z nerandomizovaných významných studií nutno zmínit prospektivní studiii [71], která ukázala příznivé výsledky léčby TNK i v období tří až šesti hodin po vzniku akutní IMP, a tedy možnost podstatného rozšíření terapeutického okénka podáním TNK při přísných indikačních kriteriích, ovšem k potvrzení těchto výsledků bude nutná randomizovaná studie.
Zkoumají se i možnosti rozšíření časového terapeutického okénka při kombinaci TNK s blokátory glykoproteinových receptorů IIb/ IIIa [72], jakož i další hledání optimální adjuvantní terapie [73].
Jak ukazují některé práce [74], lze o podání TNK uvažovat i jako o „rescue“ terapii při selhání trombolýzy prostřednictvím tPA.
Všeobecně se na tomto poli doporučují další randomizované studie s TNK [75– 78], jakož i nutnost dalšího vývoje moderních trombolytik [79].
Lze shrnout, že léčba akutních IMP prodělává v současnosti bouřlivý rozvoj, kromě dalších trombolytik se zkouší také jejich nejrůznější kombinace s dalšími antikoagulačními a antitrombotickými léky i s mechanickými reperfuzními technikami [80– 81], avšak podrobnější rozbor této velmi rozsáhlé problematiky přesahuje rámec tohoto sdělení.
Závěr
Fibrin‑specifické trombolytikum třetí generace TNK je genetickým inženýrstvím vyvinutý mutant přirozeného aktivátou plazmigenu charaktarizované vysokou rezistencí k PAI‑ l. Jeho biologický poločas umožnuje účinnou a velmi výhodnou aplikaci formou bolusové injekce. Systematicky se užívá k léčbě AIM (STEMI), možnost bolusového podání z něj činí ideální trombolytikum pro přednemocniční léčbu. Bohužel Česká republika se po stránce moderních trombolytik a přednemocniční léčby AIM jejich prostřednictvím začíná blížit rozvojovým zemím, které na moderní farmakologickou léčbu postrádají finanční zdroje. Je to výrazný kontrast ve srovnání se sousedními zeměmi, kde je přednemocniční trombolytická léčba STEMI běžnou praxí i při současném rozvinutém programů transportů k primární CI, nehledě na Francii, kde je dokonale organizována a dosahuje vynikajících výsledků i ve srovnání s primární PCI. S netrpělivostí jsou proto očekávány výsledky studie STREAM, které by měly vyjasnit vztah a srovnat přínos přednemocniční trombolytické léčby TNK (a následné akutní PCI) a transportem k primární PCI v časných hodinách po vzniku AIM, a tak stanovit optimální reperfuzní strategii v tomto období.
Z dalších klinických indikací se TNK zatím sporadicky užívá k léčbě akutní PE, akutních arteriálních periferních uzávěrů a hluboké žilní trombózy. Zde jsou dosavadní výsledky příznivé, ale zatím postrádáme podporu randomizovanými klinickými studiemi. Velmi nadějné jsou výsledky trombolytické léčby prostřednictvím TNK u ischemických mozkových příhod, zde již randomizované studie probíhají.
doc. MUDr. Stanislav Janoušek, CSc.
Interní kardiologická klinika
FN Brno‑Bohunice
stanislavjanousek@hotmail.com
Zdroje
1. Tillett WS, Garner RL. The fibrinolytic activity of hemolytic streptococci. J Exp Med 1933; 58: 485– 502.
2. Collen D, Bounameaux H, De Cock F et al. Analysis of coagulation and fibrinolysis during intravenous infusion of recombinant human tissue‑type plasminogen activator in patients with acute myocardial infarction. Circulation 1986; 73: 511– 517.
3. Ueshima S, Matsuo O. Development of new fibrinolytic agents. Curr Pharm Des 2006; 12: 849– 857.
4. Janoušek S. Trombolytická (fibrinolytická) léčba akutního infarktu myokardu. Kardioforum 2006; 4: 66– 80.
5. Tsikouris JP, Tsikouris AP. A review of available fibrin‑specific thrombolytic agents used in acute myocardial infarction. Pharmacotherapy 2001; 21: 207– 217.
6. Modi NB, Eppler S, Breed J et al. Pharmacokinetics of a slower clearing tissue plasminogen activator variant, TNK‑ tPA, in patients with acute myocardial infarction. Thromb Haemost 1998; 79: 134– 139.
7. Serebruany V, Malinin A, Callahan K et al. Effect of tenecteplase versus alteplase on platelets during the first 3 hours of treatment for acute myocardial infarction: The Assessment of the Safety and Efficacy of a New Thrombolytic Agent (ASSENT‑ 2) platelet substudy. Am Heart J 2003; 145: 636– 642.
8. Collen D, Stassen JM, Yasuda T et al. Comparative thrombolytic properties of tissue‑type plasminogen activator and of a plasminogen activator – I‑ resistant glycosylation variant, in a combined arterial and venous
thrombosis model in the dog. Thromb Haemost 1994; 72: 98– 104.
9. Keyt BA, Paoni NF, Refino CJ et al. A faster‑ acting and more potent form of tissue plasminogen activator. Proc Natl Acad Sci USA 1994; 91: 3670– 3674.
10. Benedict CR, Refino CJ, Keyt BA et al. New variant of human tissue plasminogen activator (TPA) with enhanced efficacy and lower incidence of bleeding. compared with recombinant human TPA. Circulation 1995; 92: 3032– 3040.
11. Cannnon CP, McCabe CH, Gibson CM et al. TNK‑ tissue plasminogen activator in acute myocardial infarction. Results of of the Thrombolysis in Myocardial Infarction (TIMI) 10A dose‑ranging trial. Circulation 1997; 95: 351– 356.
12. Cannnon CP, Gibson CM, McCabe CH et al. TNK‑ tissue plasminogen activator compared with front‑ loaded alteplase in acute myocardial infarction. Results of TIMI 10B trial. Circulation 1998; 98: 2805– 2814.
13. van de Werf F, Cannon CP, Luyten A et al. Safety assessment of single‑bolus administration of TNK tissue‑ plasminogen activator in acute myocardial infarction: the ASSENT‑ I trial. The ASSENT‑ I Investigators. Am Heart J 1999; 137: 786– 791.
14. Giugliano RP, McCabe CH, Antman EM et al. Lower‑dose heparin with fibrinolysis is associated with lower rates of intracranial hemorrhage. Am Heart J 2001; 141: 742– 750.
15. Van de Werf F, Adgey J, Ardissino D et al. Single‑bolus tenecteplase compared with front‑ loaded alteplase in acute myocardial infarction: the ASSENT‑ 2 double‑blind randomised trial. Assessment of the Safety and Efficacy of a New Thrombolytic Investigators. Lancet 1999; 354: 716– 722.
16. Van de Werf F, Barron HV, Armstrong PW et al. Incidence and predictors of bleeding events after fibrinolytic therapy with fibrin‑specific agents: a comparison of TNK‑ tPA and rt‑ PA. Eur Heart J 2001; 22: 2253– 2261.
17. Sinnaeve PA, Alexander JB, Belmans AC et al. One‑year follow up of the ASSENT‑ 2 trial: A double‑blind, randomized comparison of single‑bolus tenecteplas and front‑ loaded alteplase in 16,949 patients with ST elevation acute myocardial infarction. Am Heart J 2003; 146: 27– 32.
18. Assessment of the safety and efficacy of a new thrombolytic regimen (ASSENT )‑ 3 investigators. Efficacy and safety of tenecteplase in combination with enoxaparin, abciximab or unfractionated heparin: the ASSENT‑ 3 randomised trial in acute myocardial infarction. Lancet 2001; 358: 605– 613.
19. Kaul P, Armstrong PW, Cowper PA et al. Economic analysis of the assessment of the safety and efficacy of a new thrombolytic regimen (ASSENT‑ 3) study: costs of reperfusion strategies in acute myocardial infarction. Am Heart J 2005; 149: 637– 644.
20. Antman EM, Louwerenburg HW, Baars HF et al. ENTIRE‑ TIMI 23 investigators. Enoxaparin as adjunctive antithrombin therapy for ST‑elevation myocardial infarction: results of the ENTIRE‑ thrombolysis in myocardial infarction (TIMI) 23 Trial. Circulation 2002; 105: 1642– 1649.
21. Giugliano RP, Roe MT, Harrington RA et al. Combination reperfusion therapy with eptifibatide and reduced‑dose tenecteplase for ST‑elevation myocardial infarction: results of the integrilin and tenecteplase in acute myocardial infarction (INTEGRITI) Phase II Angiographic Trial. J Am Coll Cardiol 2003; 41: 1251– 1260.
22. Wallentin L, Goldstein P, Armstrong PW et al. Efficacy and safety of tenecteplase in combination with the low‑ molecular‑weight heparin enoxaparin or unfractionated heparin in the prehospital setting: the Assessment of the safety and efficacy of a new thrombolytic regimen (ASSENT)‑ 3 PLUS randomized trial in acute myocardial infarction. Circulation 2003; 108: 135– 142.
23. Armstrong PW, Chang WC, Wallentin L et al. Efficacy and safety of unfractionated heparin versus enoxaparin: a pooled analysis of ASSENT‑ 3 and‑ 3 plus data. CMAJ 2006; 174: 1421– 1426.
24. Le May MR, Wells GA, Labinaz M et al. Combined angioplasty and pharmacological intervention versus thrombolysis alone in acute myocardial infarction (CAPITAL AMI study). J Am Coll Cardiol 2005; 46: 417– 424.
25. Assessment of the safety and efficacy of a new treatment strategy with percutaneous coronary intervention (ASSENT‑ 4 PCI) investigators. Primary versus tenecteplase‑ facilitated percutaneous coronary intervention in patients with ST‑ segment elevation acute myocardial infarction (ASSENT‑ 4 PCI): randomised trial. Lancet 2006: 367: 569– 578.
26. Mcdonald MA, Fu Y, Zeymer U et al. Adverse outcomes in fibrinolytic‑based facilitated percutaneous coronary intervention: insights from the ASSENT‑ 4 PCI electrocardiographic substudy. Eur Heart J 2008; 29: 871– 879.
27. Armstrong PW. WEST Steering Committee. A comparison of pharmacologic therapy with/ without timely coronary intervention vs primary percutaneous intervention early after ST‑elevation myocardial infarction: the WEST (Which Early ST‑elevation myocardial infarction therapy) study. Eur Heart J 2006; 27: 1530– 1538.
28. Bonnefoy E, Lapostolle F, Leizorovicz A et al. Primary angioplasty versus prehospital fibrinolysis in acute myocardial infarction: a randomised study. Lancet 2002; 360: 825– 829.
29. Fernández‑ Avilés F, Alonso JJ, Peña G et al. Primary angioplasty vs early routine post‑fibrinolysis angioplasty for acute myocardial infarction with ST‑segment elevation: the GRACIA‑ 2 non‑inferiority, randomized, controlled trial. Eur Heart J 2007; 28: 949– 960.
30. Gibson CM, Karha J, Giugliano RP et al. Association of the timing of ST‑segment resolution with TIMI myocardial perfusion grade in acute myocardioal infarction. Am Heart J 2004; 147: 847– 852.
31. Sabatine MS, Cannon CP, Gibson CM et al. Investigators. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST‑segment elevation. N Engl J Med 2005; 352: 1179– 1189.
32. Sabatine MS, Cannon CP, Gibson CM et al. Effect of clopidogrel pretreatment before percutaneous coronary intervention in patients with ST‑elevation myocardial infarction treated with fibrinolytics: the PCI‑ CLARITY study. JAMA 2005; 294: 1224– 1232.
33. STREAM‑ Strategic Reperfusion (With Tenecteplase and Antithrombotic Treatment) Early After Myocardial Infarction. Drug Lib [online]. [http:/ / clinicaltrials. gov/ ct2/ show/ study/ NCT00623623?‑ show_locs=Y#locn].
34. Janoušek S, Groch L, Urbánek P et al. Léčba AIM kombinací přednemocničně podané tenekteplázy a akutní PCI. Kardiol Rev 2008; 10: 58– 61.
35. Goodman SG, Menon V, Cannon CP et al. Acute ST‑segment elevation myocardial infarction: American College of Chest physicians evidence‑based clinical practice guidelines (8th edition). Chest 2008; 133 (Suppl 6): 708S– 755S.
36. Kalla K, Christ G, Karnik R et al. Implementation of guidelines improves the standard of care: the Viennese registry on reperfusion strategies in ST‑elevation myocardial infarction (Vienna STEMI registry). Circulation 2006; 113: 2398– 2405.
37. Ting HH, Rihal CS, Gersh BJ et al. Regional systems of care to optimize timeliness of reperfusion therapy for ST‑elevation myocardial infarction: the Mayo Clinic STEMI protocol. Circulation 2007; 116: 729– 736.
38. Danchin N, Coste P, Ferrières J et al. Comparison of thrombolysis followed by broad use of percutaneous coronary intervention with primary percutaneous coronary intervention with primary percutaneous coronary intervention for ST‑segment‑ elevation acute myocardial infarction: data from the french registry on acute ST‑elevation myocardial infarction (FAST‑MI). Circulation 2008; 118: 268– 276.
39. Kamenský G, Hricák V, Studenčan M et al. Odborné usmernenie Ministerstva zdravotníctva SR pre reperfúznu liečbu akútneho infarktu myokardu s eleváciou ST segmentu. Cardiol 2007; 16: K/ C141– K/ C145.
40. Van De Werf F, Bax J, Betriu A et al. The Task Force on the management of ST‑segment elevation acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with persistent ST‑segment elevation. Eur Heart J 2008; 29: 2909– 2945.
41. Stein PD, Henry JW. Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy. Chest 1995; 108: 978– 981.
42. Tebbe U, Graf A, Kamke W et al. Hemodynamic effects of double bolus reteplase versus alteplase infusion in massive pulmonary embolism. Am Heart J 1999; 138: 39– 44.
43. Kline JA, Hernandez‑ Nino J, Jones AE. Tenecteplase to treat pulmonary embolism in the emergency department. J Thromb Thrombolysis 2007; 23: 101– 105.
44. Livaditis IG, Paraschos M. Dimopoulos K. Massive pulmonary embolism with ST elevation in leads V1– V3 and successful hrombolysis with tenecteplase. Heart 2004; 90: e41.
45. Abdulla W, Netter U. Case report. Successful use of tenecteplase in massive pulmonary embolism with cardiopulmonary resuscitation immediately following tracheostomy. Acta Anaesthesiol Belg 2005; 56: 179– 182.
46. Allocca G, Dall‘Aglio V, Nicolosi GL. Tenecteplase for massive pulmonary embolism in a 92‑year‑ old man. Ital Heart J Suppl 2005; 6: 390– 393.
47. Melzer C, Richter C, Rogalla P et al. Tenecteplase for the treatment of massive and submassive pulmonary
embolism. J Thromb Thrombolysis 2004; 18: 47– 50.
48. Caldicott D, Parasivam S, Harding J et al. Tenecteplase for massive pulmonary embolus. Resuscitation 2002; 550: 211– 213.
49. Isma‘eel H, Taher A, Alam S et al. Massive pulmonary embolism in a Lebanese patient doubly heterozygous for MTHFR and factor V Leiden presenting with syncope and treated with tenecteplase. J Thromb Thrombolysis 2006; 21: 179– 184.
50. Hovland A, Bjørnstad H, Hallstensen RF et al. Massive pulmonary embolism with cardiac arrest treated with continuous thrombolysis and concomitant hypothermia. Emerg Med J 2008; 25: 310– 311.
51. Kline JA, Hernandez‑ Nino J, Jones AE. Tenecteplase to treat pulmonary embolism in the emergency department. J Thromb Thrombolysis 2007; 23: 101– 105.
52. Goldhaber SZ. Pulmonary embolism thrombolysis: Do we need another agent? Am Heart J 1999; 138: 1– 2.
53. Spöhr F, Arntz H, Bluhmki E et al. International multicentre trial protocol to assess the efficacy and safety of tenecteplase during cardiopulmonary resuscitation in patients with out‑ of‑ hospital cardiac arrest: the Thrombolysis in Cardiac Arrest (TROICA) Study.
Eur J Clin Invest 2007; 35: 315– 323.
54. Semba CP, Sugimoto K, Razavi MK. Society of Cardiovascular and Interventional Radiology (SCVIR). Alteplase and tenecteplase: applications in the peripheral circulation. Tech Vasc Interv Radiol 2001; 4: 99– 106.
55. Melzer C, Richter C, Kröncke T et al. Fibrinolysis of acute peripheral arterial occlusion with tenecteplase – a new weight‑ optimized treatment regimen. J Thromb Thrombolysis 2004; 18: 43– 46.
56. Hull JE, Hull MK, Urso JA et al. Tenecteplase in acute lower‑ leg ischemia: efficacy, dose, and adverse events. J Vasc Interv Radiol 2006; 17: 629– 636.
57. Burkart DJ, Borsa JJ, Anthony JP et al. Thrombolysis of acute peripheral arterial and venous occlusions with tenecteplase and eptifibatide: a pilot study. J Vasc Interv Radiol 2003; 14: 729– 733.
58. Burkart DJ, Borsa JJ, Anthony JP et al. Thrombolysis of occluded peripheral arteries and veins with tenecteplase: a pilot study. J Vasc Interv Radiol 2002; 13: 1099– 1102.
59. Allie DE, Hebert CJ, Lirtzman MD et al. Novel simultaneous combination chemical thrombolysis/ rheolytic thrombectomy therapy for acute critical limb ischemia: the power‑ pulse spray technique. Catheter Cardiovasc Interv 2004; 63: 512– 522.
60. Arko FR, Davis CM 3rd, Murphy EH et al. Aggressive percutaneous mechanical thrombectomy of deep venous thrombosis: early clinical results. Arch Surg 2007; 142: 513– 518.
61. Parikh S, Motarjeme A, McNamara T et al. Ultrasound‑accelerated thrombolysis for the treatment of deep vein thrombosis: initial clinical experience. J Vasc Interv Radiol 2008; 19: 521– 528.
62. Hacke W, Donnan G, Fieschi C et al. Association of outcome with early stroke treatment: pooled analysis of ATLANTIC, ECASS, and NINDS rt‑ PA stroke trials. Lancet 2004; 363: 768– 774.
63. Saver JL. Number needed to treat estimates incorporating effects over the entire range of clinical outcomes. Arch Neurol 2004; 61: 1066– 1070.
64. Davydov L, Cheng JW. Tenecteplase: a review. Clin Ther 2001; 23: 982– 997.
65. Thomas GR, Thibodeaux H, Errett CJ et al. A long‑half‑life and fibrin‑specific form of tissue plasminogen activator in rabbit models of embolic stroke and peripheral bleeding. Stroke 1994; 25: 2072– 2078.
66. Chapman DF, Lyden P, Lapchak PA et al. Comparison of TNK with wild‑type tissue plasminogen activator in a rabbit embolic stroke model. Stroke 2001; 32: 748– 752.
67. Lapchak PA, Araujo DM, Zivin JA. Comparison of tenecteplase with alteplase on clinical rating score following small clot emoblic strokes in rabbits. Exp Neurol 2004; 185: 154– 159.
68. Haley EC Jr, Lyden PD, Johnston KC et al. TNK in Stroke Investigators. A pilot dose‑escalation safety study of tenecteplase in acute ischemic stroke. Stroke 2005; 36: 607– 612.
69. Clinical Trial. Study of tenecteplase in acute ischemic stroke (TNK‑ S2B). [http:/ / clinicaltrials. gov/ ct2/ show/ NCT00252239].
70. Stroke trials registry: TNKilas trial [online]. [http:/ / www.strokecenter.org/ trials/ TrialDetail. aspx?tid=598].
71. Parsons MW, Miteff F, Bateman GA et al. Acute ischemic stroke: imaging‑ guided tenecteplase treatment in an extended time window. Neurology 2009; 72: 915– 921.
72. Zhang L, Zhang ZG, Zhang C et al. Intravenous administration of a GPIIb/ IIIa receptor antagonist extends the therapeutic window of intra‑ arterial tenecteplase‑ tissue plasminogen activator in a rat stroke model. Stroke 2004; 35: 2890– 2895.
73. Meretoja A, Tatlisumak T. Thrombolytic therapy in acute ischemic stroke – basic concepts. Curr Vasc Pharmacol 2006; 4: 31– 44.
74. Smadja D, Olindo S, Saint‑ Vil M et al. Sequential combination of two intravenous thrombolytics (recombinant tissue plasminogen activator/ tenecteplase) in a patient with stroke and cardioembolic basilar artery occlusion. J Stroke Cerebrovasc Dis 2009; 18: 68– 71.
75. Meretoja A, Tatlisumak T. Novel thrombolytic drugs: will they make a difference in the treatment of ischaemic stroke? CNS Drugs 2008; 22: 619– 629.
76. Schumacher HC, Gupta R, Higashida RT et al. Advances in revascularization for acute ischemic stroke treatment. Expert Rev Neurother 2005; 5: 189– 201.
77. Xavier AR, Siddiqui AM, Kirmani JF et al. Clinical potential of intra‑ arterial thrombolytic therapy in patients with acute ischaemic stroke. CNS Drugs 2003; 17: 213– 224.
78. Qureshi AI, Pande RU, Kim SH et al. Third generation thrombolytics for the treatment of ischemic stroke. Curr Opin Investig Drugs 2002; 3: 1729– 1732.
79. Lopez‑ Atalaya JP, Roussel BD, Levrat D et al. Toward safer thrombolytic agents in stroke: molecular requirements for NMDA receptor‑ mediated neurotoxicity. J Cereb Blood Flow Metab 2008; 28: 1212– 1221.
80. Molina CA, Saver JL. Extending reperfusion therapy for acute ischemic stroke: emerging pharmacological, mechanical, and imaging strategies. Stroke 2005; 36: 2311– 2320.
81. Goldemund D, Mikulík R, Reif M. Trombolytická terapie mozkového infarktu. Kardiol Rev 2008; 10: 168– 176.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2010 Číslo 1
Nejčtenější v tomto čísle
- Carvedilol v léčbě kardiovaskulárních onemocnění
- Deprese u pacientů s kardiologickým onemocněním
- Tenektepláza v současné klinické praxi
- Jsou rozdíly v účinku inhibitorů ACE klinicky významné? Co říkají výsledky studií ONTARIO
