Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
Chronic cardiac failure with non-compact cardiomyopathy in a middle-aged woman
The authors present a case report of a female patient who was monitored for a period of 11 years from the “innocent“ beginnings until the clear morphological manifestation of a left ventricular non-compaction cardiomyopathy with systolic dysfunction, which was preceded by a working diagnosis of idiopathic dilated cardiomyopathy. The unfavourable development of chronic cardiac failure was reversed by decreasing the heart rate using ivabradine.
Keywords:
chronic heart failure – non-compaction cardiomyopathy – heart rate – ivabradine
Autoři:
J. Leso 1; T. Paleček 2
Působiště autorů:
Kardiologická ordinace, Městská nemocnice následné péče, Praha
1; II. Interní klinika kardiologie a angiologie, Všeobecná fakultní nemocnice, 1. LF UK Praha
2
Vyšlo v časopise:
Kardiol Rev Int Med 2011, 13(3): 193-197
Kategorie:
Kazuistika
Souhrn
V naší práci demonstrujeme kazuistiku ženy sledované po dobu 11 let od „nevinného“ začátku až po manifestaci nonkompaktní kardiomyopatie se systolickou dysfunkcí, kterému předcházela pracovní diagnóza dilatační kardiomyopatie. Nepříznivý průběh chronického srdečního selhání se podařilo ovlivnit až zpomalením srdeční frekvence ivabradinem.
Klíčová slova:
chronické srdeční selhání – nonkompaktní kardiomyopatie – srdeční frekvence – ivabradin
Popis případu
47letá žena byla ke kardiologickému vyšetření odeslána praktickým lékařem v roce 2005 po šesti letech od prvního vyšetření v kardiologické ordinaci k vyjádření pro potřeby posudkového řízení.
Iniciálně byla v kardiologické ordinaci vyšetřena v roce 1999 na požadavek ambulantního internisty pro točení hlavy, tendenci k arteriální hypertenzi, sklon k sinusové tachykardii a přechodný nález bloku levého raménka Tawarova (LBBB). Zátěžové vyšetření na bicyklovém ergometru tehdy prokázalo sníženou toleranci zátěže (4,8 METs), s fyziologickou regulací krevního oběhu a přechodným výskytem LBBB v časné fázi zotavení (obr. 1).
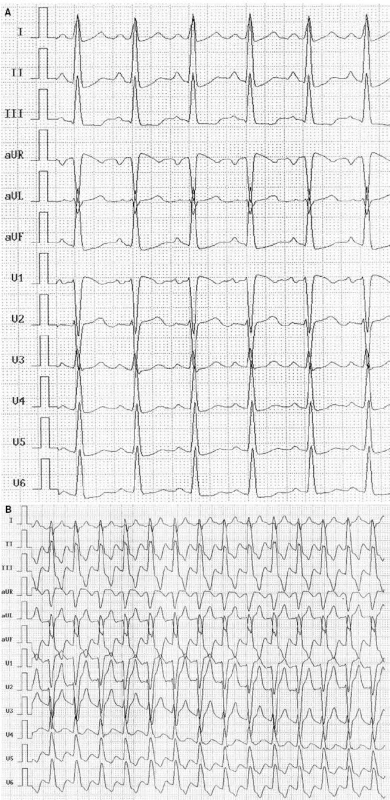
Při echokardiografii byla zjištěna hraniční velikost levé komory (LK), end-diastolický rozměr LK (LVEDD) 57 mm, end-systolický rozměr LK (LVESD) 40 mm, ejekční frakce (EF LK) 62 %, bez regionálních poruch kinetiky před zátěží i po ní, stopové regurgitace na mitrální a trikuspidální chlopni.
V říjnu roku 2005 byla pacientka ambulantně vyšetřena na III. interní kardiologické klinice FNKV pro vertigo při změně polohy a úpornou bolest hlavy. Dva týdny předtím překonala virózu, nebyla léčena a nebyla v pracovní neschopnosti. Při echokardiografii byla zjištěna středně těžká systolická dysfunkce LK, LVEDD 57 mm, difuzně hypokineze s maximem změn v oblasti septa a přední stěny. EF LK 35–40 %, stopové insuficience na mitrální a trikuspidální chlopni. Kardiospecifický soubor byl negativní. Na základě echokardiografického vyšetření byla vyslovena suspekce na proběhlou myokarditidu (nejspíše virové etiologie). Doporučenou hospitalizaci tehdy nemocná odmítla. Doporučen klidový režim, medikamentózní léčba perindopril 4 mg/den, metoprolol 50 mg/den.
Za dva týdny poté (v listopadu 2005) se pacientka dostavila do kardiologické ordinace pro zhoršení námahové dušnosti, únavnost, dráždivý kašel, stavy noční dušnosti, otok obou bérců, s obtížemi vyšla do 1. patra. Byla v pracovní neschopnosti. Při vyšetření byla klidově dušná, bez cyanózy, bez známek infektu, auskultačně na srdci cval, na plicích difuzně vlhké chrůpky, tepová frekvence 90 tepů/min, TK 140/95 mmHg, afebrilní, výška 180 cm, váha 90 kg, BMI 27,7. Na EKG byl přítomen sinusový rytmus a LBBB. Echokardiografie prokázala mírně dilatovanou LK, s náznakem kulovitého tvaru, LVEDD 60 mm a LVESD 49 mm, těžkou hypokinezi v anteroseptální oblasti, EF LK kalkulovanou dle Simpsona 30 % (obr. 2), perikardiální výpotek nebyl zjištěn. Pravostranné srdeční oddíly nebyly dilatovány. Na AV chlopních byly přítomny insuficience I. stupně, střední regurgitační gradient na trikuspidální chlopni 30 mmHg.
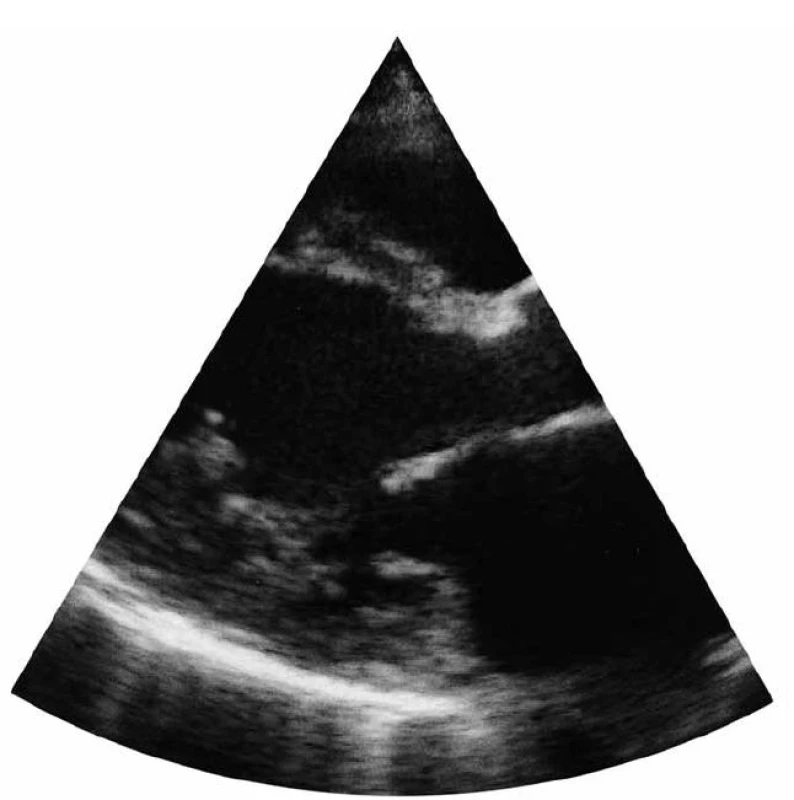
Stav pacientky byl vyhodnocen jako dilatační kardiomyopatie vs virové etiologie se známkami levostranné kardiální dekompenzace NYHA II.–III. třídy, při přítomnosti známek plicní hypertenze mírného stupně. Navrženou hospitalizaci opět nemocná odmítla. Pacientka byla poučena o závažnosti zdravotního stavu, byl jí doporučen klidový režim, zakázáno kouření a vydány pokyny pro srdeční selhání. Medikamentózně byl předepsán digoxin 0,125 mg/den, perindopril 4 mg/den, furosemid 40 mg/den, spironolakton 25 mg/den, trimetazidin 60 mg/den (k podpoře energetické bilance myokardu [1]). Klinický a funkční stav pacientky se postupně zlepšil na NYHA II.
Po viróze v roce 2006 se celkový stav nemocné opět zhoršil. Udávala prekolapsové stavy, zvládala chůzi jen mírné intenzity bez zadýchání, budila se pro dušnost. Odeslána do ordinace kardiomyopatií na II. interní kliniku kardiologie a angiologie VFN a 1. LF UK a následně byla hospitalizována. Zjištěné nálezy jsou uvedeny v přehledu:
Virologie: Hepatitidy HBsAG negativní, HBeAg negativní. Herpetické viry: negativní až na AntiHSV1 IgG. CMV: negativní. EBV-EBNA1 IgG: pozitivní.
Echokardiografie: LK vzhledem k BSA při horní hranici normy, kulovitého tvaru, difuzně hypokinetická, EF LK 32 %. Porucha diastolické funkce I. stupně. Systolická funkce PK je dobrá. Mitrální regurgitace 2. stupně, trikuspidální regurgitace 1.–2. stupně s gradientem svědčícím proti hypertenzi v plicnici. V oblasti síňového septa patrno aneuryzmatické vyklenování, bez průkazu zkratového proudění.
Koronarografie: Normální nález na věnčitých tepnách. Levografie: LK není dilatována, EDV 145 ml, EF LK 40 % s mírnou difuzní hypokinezí. TK v LK 160/17/28 mmHg. Není gradient na aortě.
Endomyokardiální biopsie: bez zánětlivé infiltrace, bez průkazu virů v myokardu.
V závěru byla uvedena pracovní diagnóza: dilatační nespecifikovaná kardiomyopatie se systolickou dysfunkcí, chronické kardiální selhání, NYHA II. třídy. Pacientka byla propuštěna s doporučenou medikací: metoprolol succinat 100 mg/den, perindopril 4 mg/den, hydrochlorothiazid 25 mg/den, spironolakton 25 mg/den, trimetazidin 60 mg/den.
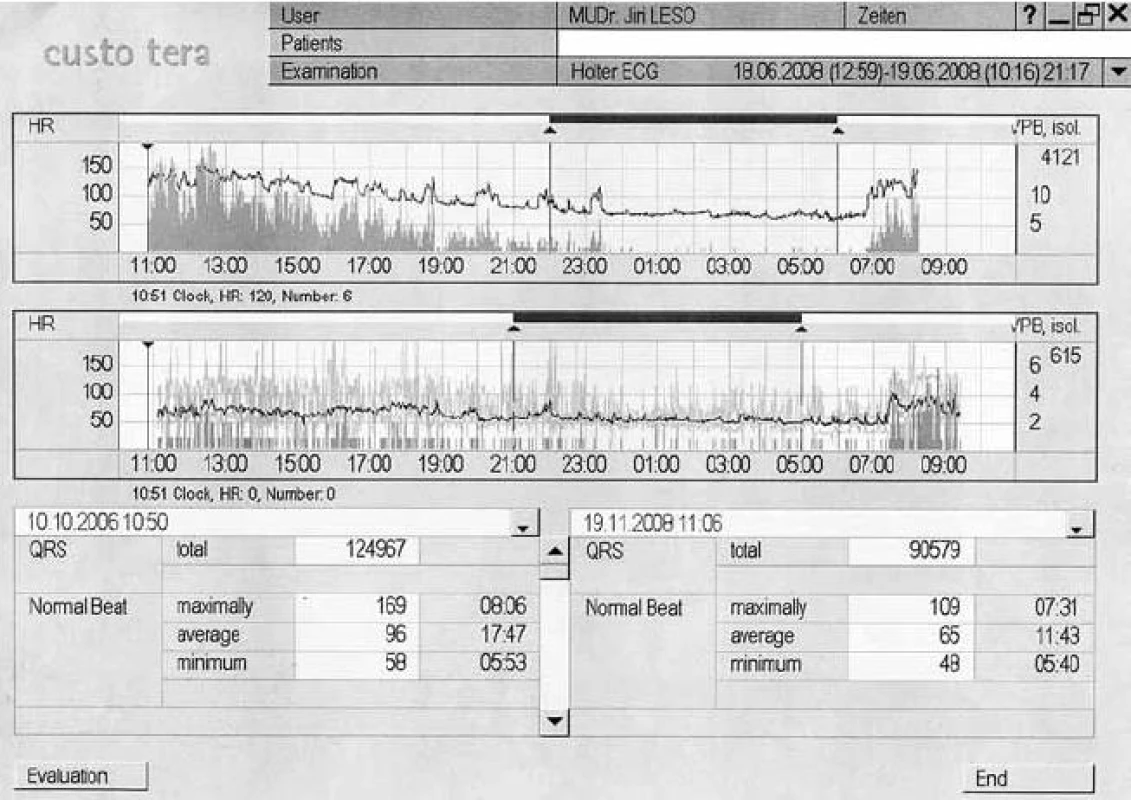
Počátkém roku 2008 překonala virózu a od té doby pociťovala rychlé bušení srdce, omezení výkonnosti pro dušnost a únavu. Při klinickém vyšetření a na EKG byla zjištěna sinusová tachykardie 100–110 tepů/min (přítomen LBBB) nereagující uspokojivě na podání metoprololu v dávce až 300 mg/den, proto byl k medikaci přidán ivabradin (2 × 5 mg) jako léčebná alternativa (selektivní a specifický inhibitor If kanálu působící v sinoatriálním uzlu [2]). Při následné kontrole za 14 dnů došlo nejenom k poklesu srdeční frekvence na 75 tepů/min, ale také k ústupu námahové dušnosti. Dokladem příznivých změn bylo Holterovské monitorování EKG. Došlo k poklesu QRS komplexů za 24 hod ze 124 967 na 90 579 a průměrná hodnota SF se snížila z 96 tepů/min na 65 tepů/min (obr. 3).
V průběhu následujících tří let, tj. 2008 až 2010 byl zdravotní stav pacientky uspokojivý a nebyla nutná hospitalizace pro recidivu srdečního selhání. V roce 2010 bylo doplněno v ordinaci kardiomyopatií Všeobecné fakultní nemocnice MRI srdce s nálezem: snížená systolická funkce mírně sféricky dilatované levé komory, EF LK 50 %. Nález splňuje kritéria nonkompaktní kardiomyopatie (obr. 4).
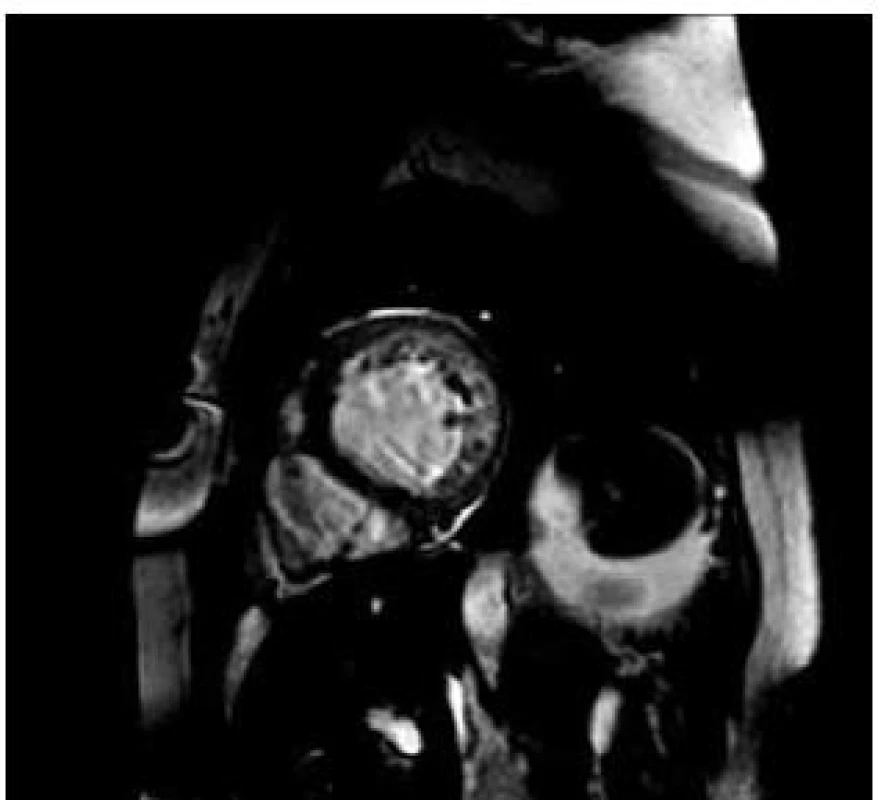
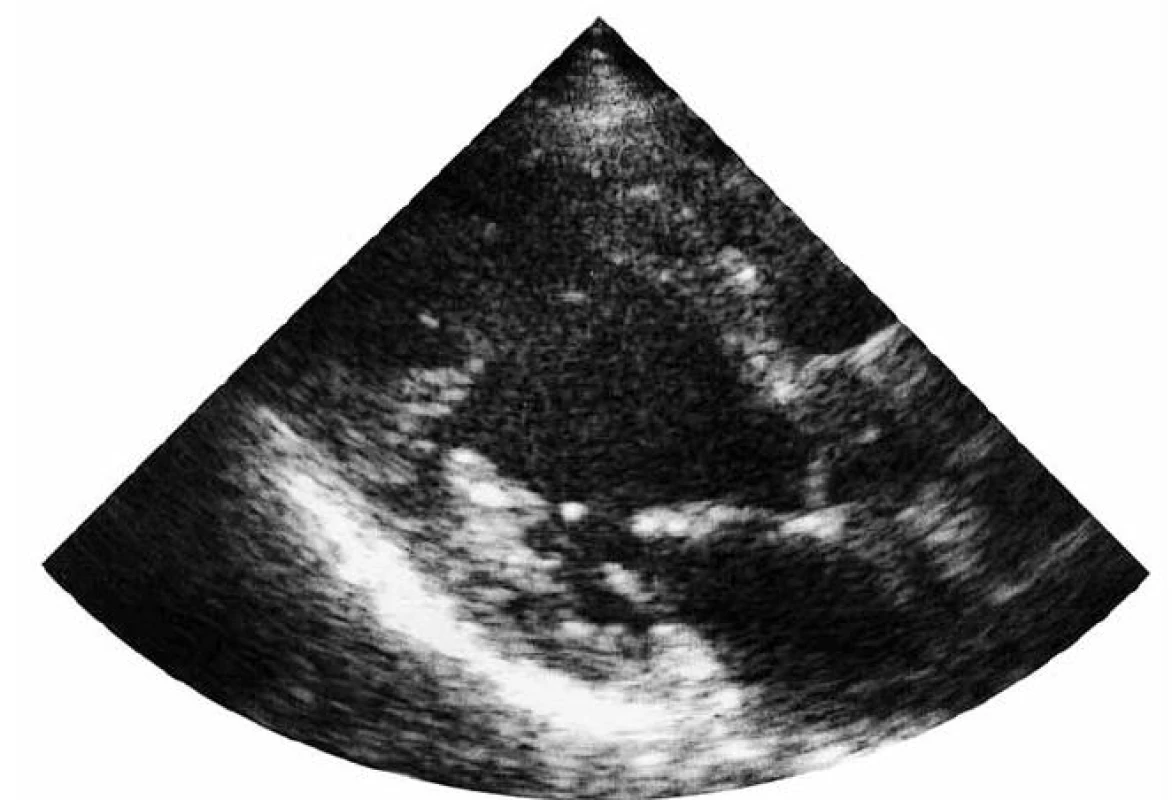
Při echokardiografii (obr. 5) byla zjištěna mírně dilatovaná levá komora (LVEDD 62 mm), sféricky remodelovaná s hypertrabekulizací posteroapikálně. Globální systolická funkce LK v důsledku poklesu tepové frekvence se zlepšila na 50 %. Porucha diastolické funkce LK mírného stupně. Levá síň je mírně dilatována. Pravostranné srdeční oddíly nezvětšeny, s dobrou systolickou funkcí pravé komory. Středně významná mitrální insuficience 2. stupně a trikuspidální insuficience 1. stupně.
Diskuze
Chronické srdeční selhání a nález dilatační kardiomyopatie představuje v každém věku v kardiologické ordinaci dilema jak diagnostické, tak i léčebné. Srdeční selhání s retencí tekutin, arytmiemi a vyššími hodnotami srdeční frekvence (nad 85/min) je provázeno horší prognózou [3].
Nonkompaktní kardiomyopatie levé komory (LVNC) je nedávno a stále více poznávanou formou kardiomyopatie. Je charakterizována nadměrnou trabekulární vrstvou a rozmanitou hloubkou intertrabekulárních výklenků zesilujících dutinu komorové stěny. Patogeneticky se pravděpodobně uplatňuje zastavení normálního procesu kompaktnosti v časné fázi fetálního života. LVNC se zdá být morfologickou abnormalitou s genetickou heterogenitou. V roce 2006 klasifikovala American Heart Assotiation tuto jednotku jako primární kardiomyopatii genetického původu. Diagnóza je zpravidla stanovena pomocí echokardiografie nebo MRI. Pro LVNC svědčí poměr nonkompaktní vůči kompaktní vrstvě myokardu větší než 2,0 v endsystole při echokardiografii, při magnetické rezonanci pak 2,3 : 1 v diastole. Prognóza se zpočátku považovala za velmi špatnou, ale tento názor se v posledních letech změnil. Specifická léčba LVNC neexistuje. Nemocní jsou léčeni klasickou terapií srdečního selhání – inhibitory angiotenzin konvertující enzymy, betablokátory, srdečními glykosidy a diuretiky. Antikoagulační léčba je doporučována vždy po embolizační příhodě a je velmi vhodná i u symptomatických nemocných se snížením EF LK již pod 40 %. Transplantace srdce je poslední možností u případů refrakterních na konzervativní léčbu [4,5].
V léčbě chronického srdečního selhání je nutné korigovat tepovou frekvenci a krevní tlak a tím docílit snížení práce srdce, spotřeby kyslíku myokardem a prodloužení diastolického plnění LK. V důsledku nižší tepové frekvence byl též zjištěn pokles hustoty kolagenu a vzestup hustoty kapilár v LK, a to beze změn její hmotnosti. Pokles tepové frekvence představuje benefit pro pacienta a bývá spojen s lepší kvalitou života. Význam redukce tepové frekvence byl doložen řadou studií s betablokátory MERIT-HF [6], CIBIS II [7], US Carvedilol Trials [8] a další.
Betablokátory mají nepochybně zastoupení v léčbě CHSS, avšak mají také svá úskalí – kontraindikace (u pacientů s asthma bronchiale, hypotenzí, poruchou AV vedení, relativně i s ischemickou chorobou dolních končetin) a kromě toho při snaze o dosažení cílové dávky mohou vyvolat nežádoucí účinky (stavy slabosti, nespavost, hypotonii, dyspnoe) vyžadující přerušení léčby.
Klinicky efektivní se zdá být ivabradin, první představitel lékové skupiny označované jako inhibitory f – kanálů (tzv. bradinů). Mechanizmus účinku spočívá v inhibici specifického draslíkového If proudu v buňkách sinusového uzlu, což vede ke snížení fáze diastolické depolarizace akčního potenciálu sinusového uzlu. Výsledkem je negativně chronotropní účinek bez ovlivnění rychlosti vedení vzruchu či kontraktility myokardu [9]. Zpomalení srdeční frekvence vede k prodloužení diastoly, tj. doby, kdy krev protéká koronárními tepnami. Tím se zvyšuje přísun kyslíku do myokardu. Ivabradin navíc během zátěže nedemaskuje (na rozdíl od betablokátorů) α-adrenergní koronární vazokonstrikci [10]. Ivabradin se ukázal být přínosný v případech rychlé srdeční akce u selhávajícího srdce. Svědčí pro to studie, které testovaly jeho hemodynamický účinek u pacientů s chronickým srdečním selháním v kombinaci s betablokátory. Bylo prokázáno, že již po šesti týdnech léčby ivabradinem (přidaným ke standardní léčbě včetně betablokátorů) se signifikantně zvýšila EF LK a snížil se endsystolický objem LK, což dokládá příznivý vliv na kontraktilitu selhávajícího myokardu [11,12]. Bylo prokázáno, že specifická inhibice sinoatriálního pacemakerového If proudu ivabradinem vede k poklesu tepové frekvence v klidu i při zátěži, což je příznivé pro selhávající srdce. Kromě toho blokuje také rychlost If proudu v myocytech komory (arytmogenní trigger) a to by mohlo přispět k redukci rizika náhlé smrti [13]. V klinické praxi se potvrdilo, že ivabradin může být kombinován s běžně používanými léky u pacientů s chronickým srdečním selháním bez rizika vzniku nežádoucích lékových interakcí či závažných nežádoucích vedlejších účinků.
Studie SHIFT [14], jejíž výsledky byly uvedeny u příležitosti kongresu Evropské kardiologické společnosti v září 2010 a souběžně publikovány v časopise Lancet, byla první studií, která hodnotila účinek snížení tepové frekvence na stav pacientů s chronickým srdečním selháním ať již ischemické, či neischemické etiologie. Do studie byli vybráni nemocní léčeni pro srdeční selhání a systolickou dysfunkci LK (EF LK ≤ 35 %). Tepová frekvence nemocných při vstupu do studie byla ≥ 70 tepů/min. Většina z nich užívala betablokátory (89 % pacientů) a antagonisty RAAS (91 % pacientů). Po 28 dnech léčby poklesla tepová frekvence u pacientů s ivabradinem průměrně o 15,4 tepů/min z průměrné vstupní hodnoty 80 tepů/min. Primární sledovaný parametr, tj. kardiovaskulární mortalita nebo hospitalizace z důvodu srdečního selhání, i sekundární sledované parametry, tj. hospitalizace pro srdeční selhání a úmrtí pro srdeční selhání, se při podávání ivabradinu statisticky významně snížily. Studie tak potvrdila myšlenku, že srdeční frekvence zaujímá významnou roli v patofyziologii chronického srdečního selhání a že její korekce může ovlivňovat průběh choroby [15].
Závěr
V našem sdělení demonstrujeme kazuistiku ženy středního věku s nonkompaktní kardiomyopatií komplikovanou srdečním selháním, a to od roku 1999 až po první epizodu levostranného srdečního selhání v roce 2005 progredující v důsledku nedostatečně korigované tepové frekvence i při podávání vysoké dávky betablokátoru. I když ivabradin není zatím indikován pro chronické srdeční selhání, jeho podávání v kombinaci s betablokátorem a inhibitorem ACE a režimovými opatřeními u pacientky s později (v roce 2008) verifikovanou nonkompaktní kardiomyopatií prokázalo dlouhodobý klinický efekt, zlepšení kvality života nemocné, pozitivní vliv na hemodynamiku a bezpečnost léčby po dobu více než tří let. Výsledky recentně publikované studie SHIFT potvrzují zkušenosti získané klinickou praxí.
Doručeno do redakce 13. 7. 2011
Přijato po recenzi 15. 8. 2011
MUDr. Jiří Leso1
doc. MUDr. Tomáš Paleček, Ph.D.2
1 Kardiologická ordinace, Městská nemocnice následné péče, Praha
2 II. Interní klinika kardiologie a angiologie, Všeobecná fakultní nemocnice, 1. LF UK Praha
leso.kardio@mnnp.cz
Zdroje
1. Kantor PF, Lucien A, Kozak R et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase. Circ Res 2000; 86: 580–588.
2. Pharmakokinetics of ivabradine. Summary of Product Characteristic. London, UK: EMEA, October 25, 2005.
3. Mulder O, Barbier S, Chagraoui A et al. Long-term heart rate reduction induced by the selective I(f) current inhibitor ivabradine improves left ventricle function and intrinsic myocardial structure in congestive heart failure. Circulation 2004; 109: 1674–1679.
4. Ganame J, Ayres NA, Pignateli RH. Left ventricular noncompaction, a recently recognized form of cardiomyopathy. Insuf Cardiaca 2006; 3: 119–124.
5. Sarma RJ, Chana A, Elkayam U. Left ventricular noncompaction. Prog Cardiovasc Dis 2010; 52: 264–273.
6. Wikstrand J, Hjalmarson A, Waagstein F et al. MERIT-HF Study Group. Dose of metoprolol CR/XL and clinical outcome in patiens with heart failure: analysis of the experience in metoprolol CR/XL randomized intervention trial in chronic heart failure (MERIT-HF). J Am Coll Cardiol 2002; 40: 491–498.
7. Lechat P, Hulot JS, Escolano S et al. Heart rate and cardiac rythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II Trial. Circulation 2001; 103: 1428–1433.
8. Packe M, Bristol MR, Cohn JN et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. N Engl J Med 1996; 334: 1349–1355.
9. DiFrancesco D. If current inhibitors: properties of drug-channel interaction. In: Fox K (ed.). Selective and specific If channel inhibition in cardiology. London, UK: Science Press 2004: 1–13.
10. Colin P, Ghaleh B, Monnet X et al. Contributions of heart rate and contractility to myocardial oxygen balance during exercise. Am J Physiol Heart Circ Physiol 2003; 284: H676–H682.
11. Jondeau G, Korewicki J, Vasiliauskas D. Effect of ivabradine in patiens with left ventricular systolic dysfunction and coronary heart disease. Eur Heart J 2004; 25 (Suppl): 451.
12. Jondeau G, Bohm M, Tavazzi L et al. Hemodynamic effect of ivabradin, a pure heart rate lowering agent, in patiens with severe systolic chronic heart failure receiving betablockers. Eur J Heart Failure Suppl 2008; 7 (Suppl 1).
13. Cerbai E, Pino R, Porciatti F et al. Characterization of repolarization-activated current, I(f), in ventricular myocytes from human failing heart. Circulation 1997; 95: 568–571.
14. Swedberg K, Komajda M, Böhm M et al. SHIFT Investigators. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet 2010; 376: 875–885.
15. Böhm M, Swedberg K, Komajda M et al. SHIFT Investigators. Heart rate as a risk factor in chronic heart failure (SHIFT): the associaton between heart rate and outcomes in a randomised placebo-controlled trial. Lancet 2010; 376: 886–894.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2011 Číslo 3
Nejčtenější v tomto čísle
- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Home monitoring a implantáty
