Endovaskulární léčba disekce aorty typ B a ischemických komplikací provázejících aortální disekce
Endovascular treatment of type B aortic dissection and ischaemic complications accompanying aortic dissections
The topic of this paper is the endovascular treatment of thoracic aortic dissection Stanford type B and treatment of ischaemic complications associated with aortic dissection. This method leads to thrombosis of the false lumen in the descending thoracic aorta and its stabilisation, remodelling and prevention of subsequent rupture. We have demonstrated the positive impact of a successful endovascular treatment of aortic remodelling and consolidation within 3 years after the implantation of the stent graft. We have shown a gradual decline of the overall diameter of the aorta in the descending thoracic aorta, especially at the expense of reducing the volume of the false channel, with a gradual increase in the size of the true channel. This positive trend was present in patients treated in acute or subacute stages of dissection as well as in the chronic stage of aortic dilatation. Very interesting and important to us is the subsequent development of the overall width of the aorta, the false and true channel in the abdominal aorta, which is not treated with a stent graft, and in most cases, a perfusion of the false channel persists due to a re-entry at the site of a distance between visceral and renal arteries. Despite the false channel perfusion, however, there is no dilatation of the abdominal aorta, and the size of the true and false channel does not change in time.
Keywords:
aortic dissection type B – true lumen – false lumen
Autoři:
D. Kučera 1,2; M. Válka 1; J. Kozák 1; J. Bezecný 1; J. Krátký 1; V. Jetmar 1
Působiště autorů:
Vaskulární centrum, Vítkovická nemocnice a. s, Ostrava
1; II. interní klinika kardiologie a angiologie 1. LF UK a VFN v Praze
2
Vyšlo v časopise:
Kardiol Rev Int Med 2016, 18(3): 163-172
Souhrn
Tématem sdělení je endovaskulární léčba disekcí hrudní aorty typ B Stanfordské klasifikace a léčba ischemických komplikací provázejících aortální disekce. Tato metoda vede k trombóze falešného lumen v oblasti sestupné hrudní aorty s její stabilizací, remodelací a prevencí následné ruptury. V naší práci jsme demonstrovali pozitivní vliv úspěšné endovaskulární léčby na remodelaci a konsolidaci aorty v rozmezí tří let po implantaci stentgraftu. Prokázali jsme postupné zmenšování celkového průměru aorty v oblasti sestupné hrudní aorty, a to především na úkor zmenšování objemu falešného kanálu s postupným nárůstem velikosti pravého kanálu. Tento pozitivní trend byl přítomen jak u pacientů léčených v akutním či subakutním stadiu disekce, tak i ve stadiu chronické dilatace aorty. Velmi zajímavý a pro nás důležitý je následný vývoj celkové šíře aorty, falešného a pravého kanálu v oblasti abdominální aorty, která není stentgraftem ošetřena a ve většině případů zde z důvodu reentry v místě odstupu viscerálních a ledvinných tepen přetrvává perfuze falešného kanálu. I přes perfuzi falešného kanálu však nedochází k dilataci aorty a velikost pravého a falešného kanálu se v čase nemění.
Klíčová slova:
aortální disekce typ B – pravé lumen – falešné lumen
Úvod
Incidence aortální disekce typu B čítá v populaci 1–2 pacienty na 1 mil. obyvatel s prevalencí mužského pohlaví 2–3: 1 [1,2]. I přes tuto velmi nízkou incidenci si však vzhledem ke své mortalitě a morbiditě jak v akutní fázi, tak v následném průběhu jistě zaslouží naši pozornost. Doposud byla disekce hrudní aorty typu B léčena ve velké většině případů konzervativně s cca 10–20% mortalitou [3]. Komplikace spojené s tímto onemocněním v akutní fázi, jako projevy ischemie v oblasti orgánů zásobované viscerálními větvemi abdominální aorty či končetinová ischemie, jsou řešeny akutním chirurgickým výkonem s mortalitou 25–35 % [4]. Navíc i u stabilizovaných pacientů léčených konzervativně dochází v následném období až v 35 % k progresivní dilataci sestupné hrudní aorty s velmi špatnou prognózou a exponenciálně se zvyšujícím rizikem ruptury, pokud celkový rozměr aorty překročí hranici 50 mm.
Vzhledem k poměrně složité operační technice resekce disekce či aneuryzmatu sestupné hrudní aorty a s obavou před rozvojem spinální ischemie se od poloviny 80. let minulého století rozvíjí nová miniinvazivní metoda – perkutánní endovaskulární léčba. První větší soubory pacientů s aneuryzmatem sestupné hrudní aorty léčených endovaskulárně byly publikovány začátkem 90. let minulého století. Vedoucí roli v rozvoji této techniky mělo Stanfordské pracoviště kolem doktora M. Dake. Zpočátku to byly především tzv. home made stentgrafty, které byly připravovány pacientům na míru samotnými lékaři ve spolupráci s jednotlivými firmami. Tomu odpovídalo jak technicky nedokonalé zpracování stentgraftu, většinou samoexpandabilní „Z“ stent fixovaný na dacronové či PTFE cévní protéze, tak kvalita zavádějícího systému. Následná léta jsou charakteristická rychlým rozvojem vysoce propracovaných zaváděcích systémů a průmyslovou výrobou hrudních tubulárních stentgraftů (obr. 1).

Postupně jsou selektovány jak skupiny pacientů, tak i patologických stavů, které jsou pro endovaskulární léčbu nejvhodnější. Při rychlém technickém rozvoji vlastních stentgraftů a zavádějícího instrumentária s důrazem na větší flexibilitu systému, atraumatičnost a co možná nejmenší průměr se stále více a více rozšiřují indikace a možnosti tohoto typu léčby, která je ve srovnání s otevřenou chirurgií sestupné hrudní aorty zatížena menším rizikem komplikací, kratším pobytem na jednotkách intenzivní pooperační péče, celkovou dobou hospitalizace a dobou opětovného zapojení se do pracovního procesu [5]. Endovaskulární léčba má poněkud benevolentnější kritéria indikace k léčbě ve srovnání s otevřenou chirurgií, což je dáno její miniinvazivitou, menším počtem komplikací, nižší periprocedurální a hospitalizační morbiditou a mortalitou. Jedinou limitací endovaskulární léčby jsou v dnešní době nevhodné anatomické poměry a dokumentovaný anafylaktický šok po podání kontrastní láky. Relativní kontraindikací endovaskulární léčby jsou patologie vzniklé na podkladě vrozeného onemocnění pojiva (Marfanův syndrom, Ehlers-Danlosův syndrom) z důvodu předpokládané dilatace aorty jako projev přirozeného vývoje onemocnění, což by v dlouhodobém průběhu mohlo vést k nebezpečí migrace stentgraftu.
Základní názvosloví spojené s aortální disekcí a endovaskulární léčbou
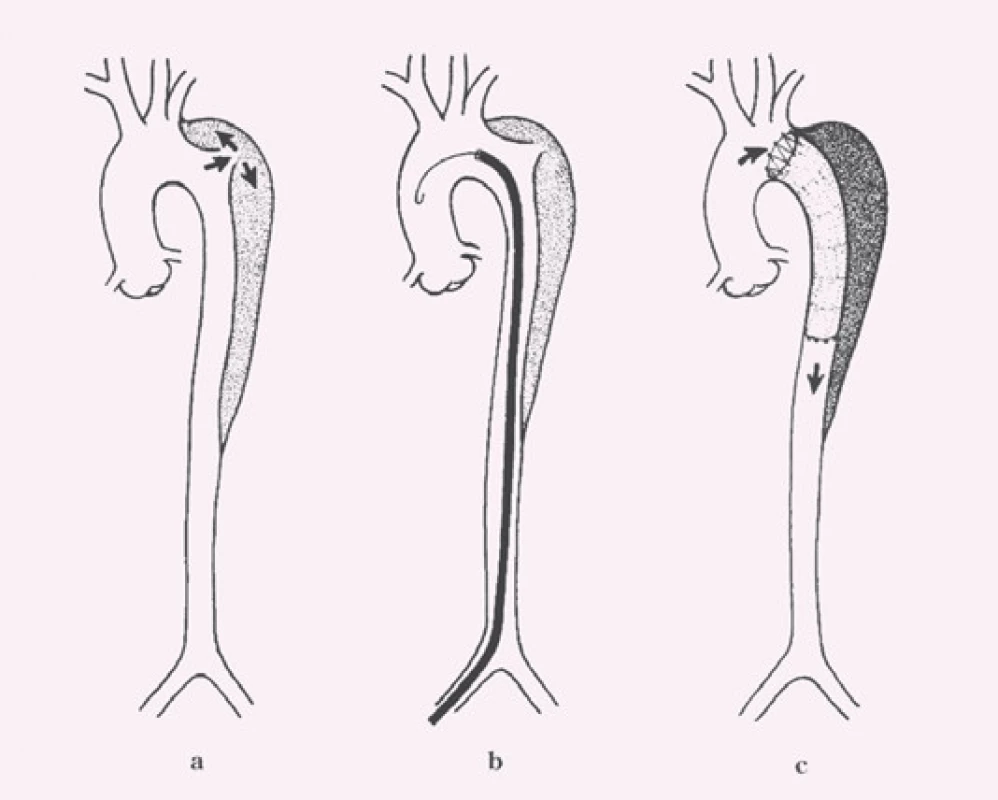
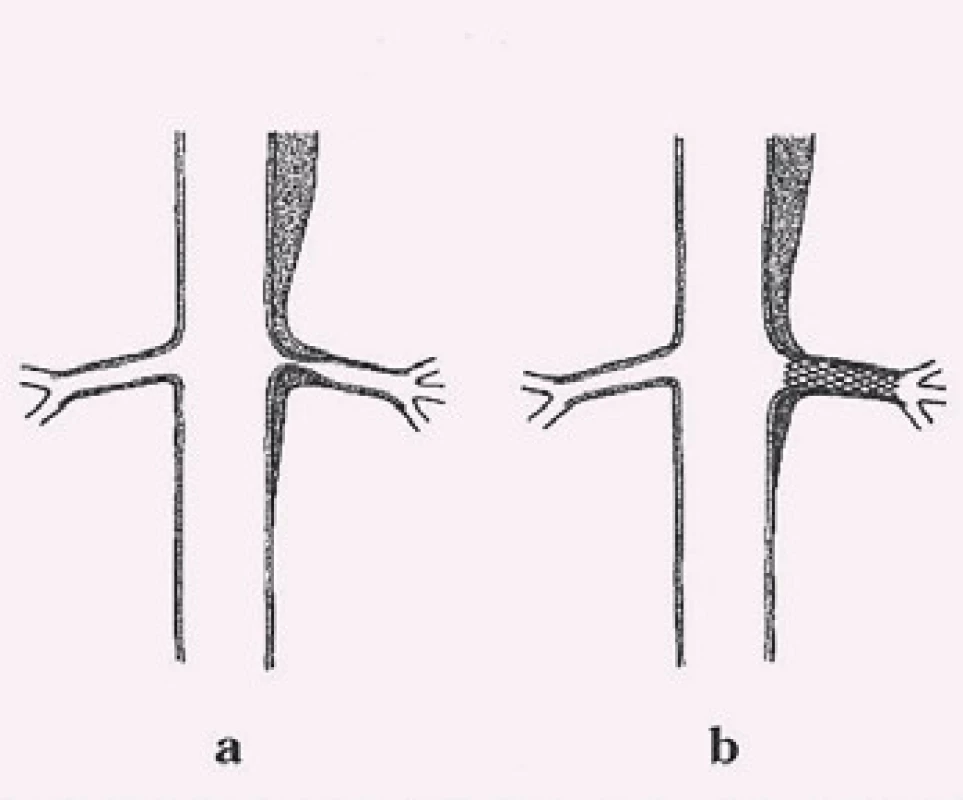
Disekce – rozdělení původně jediného lumen cévy na dvě části z důvodu podélného natržení stěny cévy, primární entry – místo původního natržení stěny cévy, od kterého se disekce začíná šířit, reentry – místo komunikace mezi pravým a nepravým lumen mimo primární entry, intimal flap – membrána oddělující pravé a nepravé lumen tvořená endotelem a různě silnou vrstvou médie cévy podle toho, jak hluboko zasáhl primární disekční inzult stěnu cévy, pravé (true) lumen (kanál) – původní lumen cévy tvořené po obvodu jednak všemi strukturami cévní stěny a jednak intimal flapem, nepravé (false) lumen (kanál) – lumen vytvořené ve stěně cévy ohraničené po obvodě intimal flapem a zbytkem médie cévy s adventicií (obr. 2).
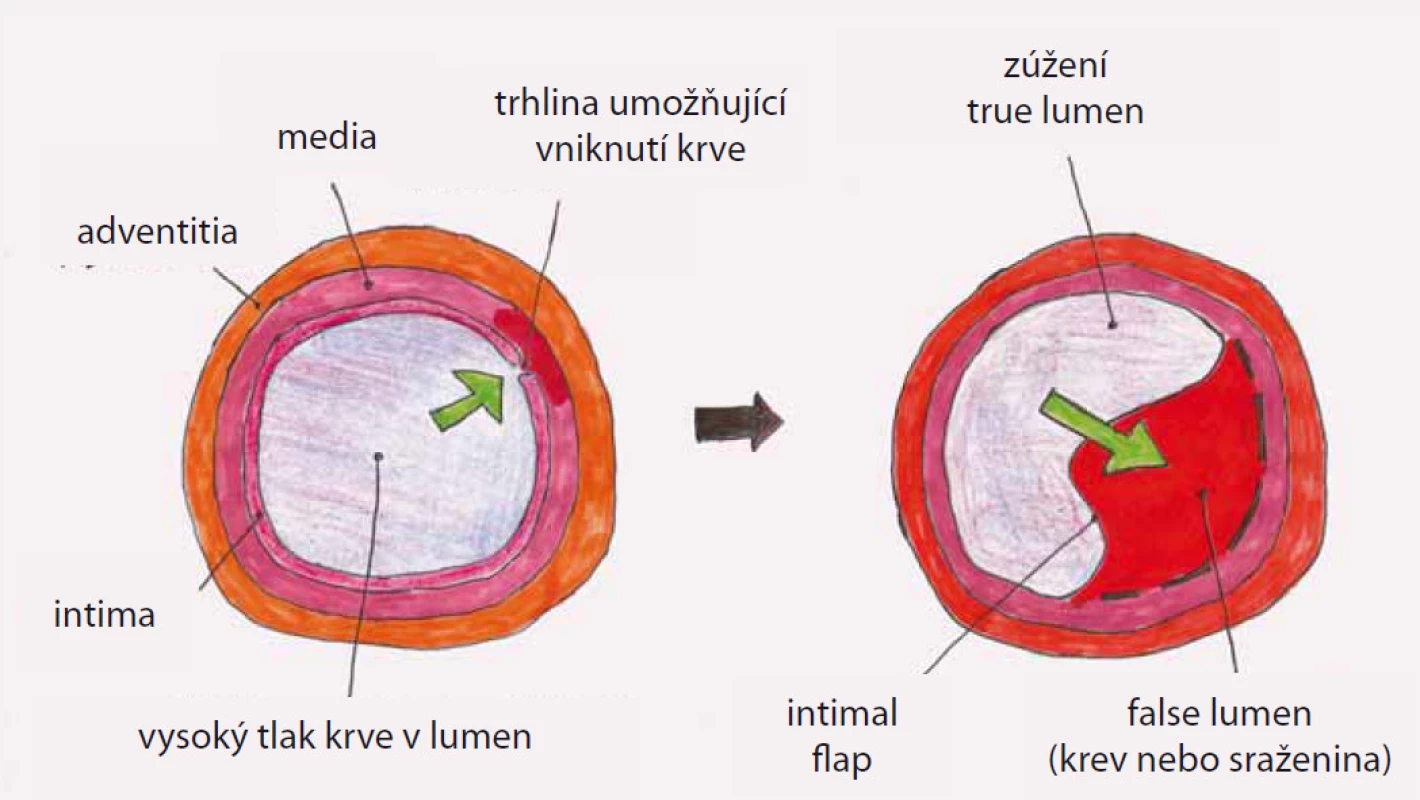
Terminologie související s endovaskulárním výkonem zahrnuje
Přístupová cesta – cévní řečiště, kterým procházíme zaváděcím systémem do místa implantace stentgraftu, proximální krček – je úsek cévy (kotvicí zóna) mezi první, směrem k srdci uloženou funkčně důležitou tepnou, kterou nelze překrýt stentgraftem a primárním entry či začátkem disekce (u disekcí sestupné hrudní aorty je to povětšinou úsek aorty mezi proximálním ohraničením disekce a levou podklíčkovou či společnou karotickou tepnou), distální krček – úsek sestupné hrudní či břišní aorty mezi nejvíce distálně uloženým významným reentry a první tepnou nacházející se pod tímto reentry, jejíž překrytí by vyvolalo významné ischemické komplikace (pro disekce sestupné hrudní aorty je to vzdálenost distálního reentry k odstupu a coeliaca), proximální kotvicí zóna – předpokládaný úsek proximálního krčku, který bude překryt stentgraftem, distální kotvicí zóna – předpokládaný úsek distálního krčku, který bude překryt graftem, stentgraft – cévní protéza vyztužená povětšinou samoexpandabilním ocelovým či nitinolovým stentem, zaváděcí instrumentárium – speciálně upravený zavaděč uzpůsobený k atraumatickému zavedení a vypuštění stentgraftu v místě primárního entry, modulační balon – latexový, nízkotlaký dilatační katetr používaný k dodilataci stentgaftu v oblasti proximálního a distálního krčku. Při sledování úspěšnosti léčby se hodnotí úplnost trombózy falešného kanálu aortální disekce či zatékání krve do vaku falešného kanálu – tzv. endoleak. Ten může být dle mechanizmu vzniku několikerého typu. Prognosticky nejzávažnější je endoleak I. typu, který vzniká plněním vaku false lumen z důvodu netěsnosti stentgraftu v oblasti proximální či distální kotvicí zóny. Při endoleaku II. typu dochází k plnění false lumen z kolaterálního toku cestou cév, které vystupují z falešného kanálu. Endoleak III. typu je vázán na poruchu integrity stentgraftu, a tím i cévní protézy, a endoleak IV. typu je spojen s propustností cévní protézy z důvodu její zvýšené porozity.
Diagnostika aortální disekce typu B
Diagnostika aortální disekce typu B se zakládá především na vyšetření spirální CT angiografií (CTA), jícnovou echokardiografií, digitální subtrakční angiografií (DSA), MR angiografií či intravaskulárním ultrazvukem.
Spirální CT angiografie
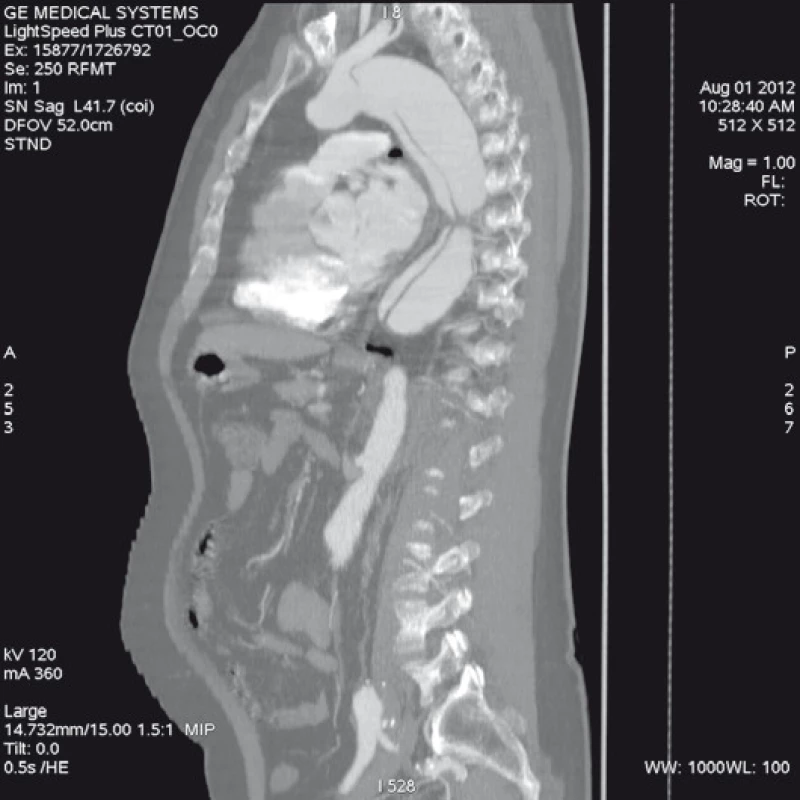
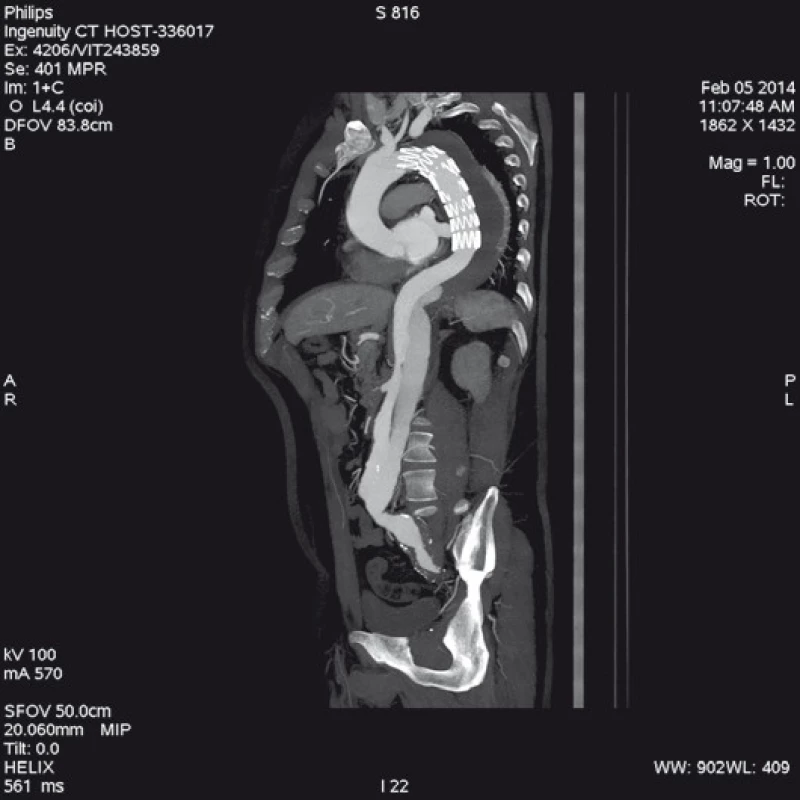
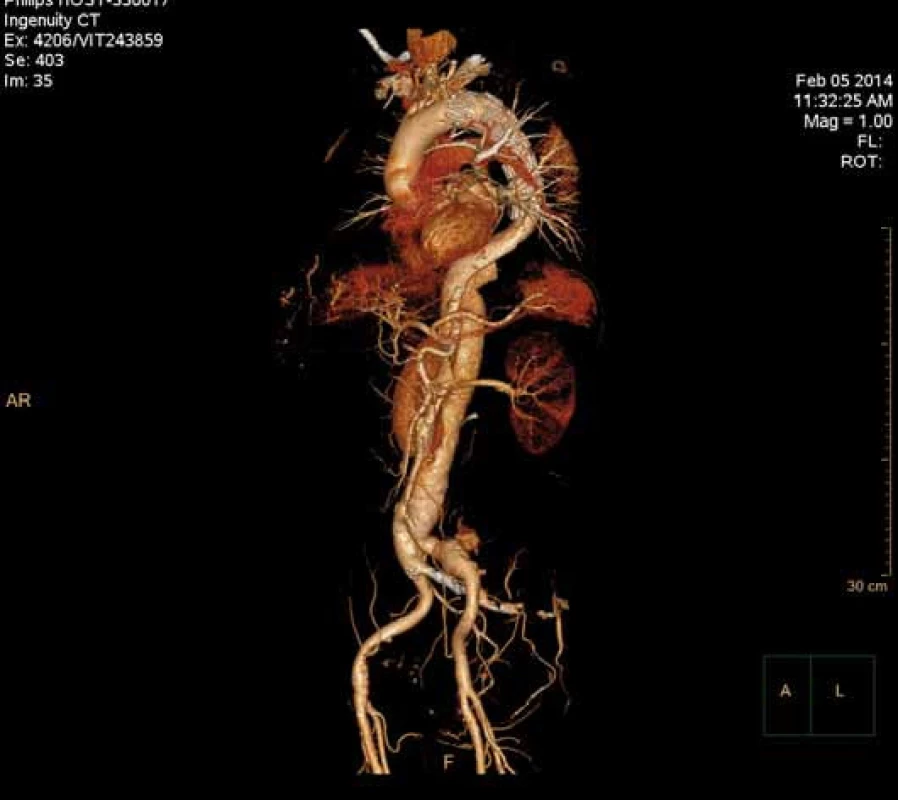
Má vzhledem k své všeobecné rozšíře- nosti a dostupnosti zásadní význam jed- nak při diagnostice disekcí aorty typu B, ale jednak i při plánování vlastní endovaskulární procedury. Její význam je v určení rozsahu disekce, stanovení dilatace aorty, event. její ruptury, zhodnocení trombózy false lumen, vzájemného poměru velikosti pravého a falešného lumina, kolapsu pravého lumen, lokalizace primárního entry, a reentry site, odstupu jednotlivých větví aorty z pravého či falešného kanálu či přítomnosti statické obstrukce větví aorty. CTA je přesná především v hodnocení velikosti a rozsahu disekce, ruptury aorty a odstupu jednotlivých větví z pravého či falešného kanálu (obr. 3–5). Zhodnocení lokalizace primárního entry, reentry či přítomnosti dynamické či statické obstrukce větví aorty již vyžaduje jednak kvalitní multirovinný CT přístroj a jednak velkou zkušenost vyšetřujícího. CTA byla taktéž základním paraklinickým vyšetřením pro diagnostiku, plánování a kontrolu našich pacientů. Aby byla co nejvíce eliminována chyba měření jednotlivých pacientů v čase týkající se měření v přesně anatomicky definovaných oblastech a chyba měření odvislá od vyhodnocující osoby, byla určena následující pravidla. Jako anatomicky definovaná místa pro jednotlivá měření aorty byly určeny: oblast oblouku aorty mezi odstupy arteria carotis communis (ACC) sin a arteria subclavia (AS) sin, a to co možná nejblíže odstupu AS sin. Tento rozměr ve většině případů určoval proximální anatomický krček pro implantaci stentgraftu a jeho plocha byla brána jako referenční rozměr pro plánování průměru graftu. Další anatomická místa pro následné sledování byla vztažena k odstupu velkých tepen aorty, a to k odstupu AS sin, a. celiaca a renálních tepen (AR) z důvodu standardizace a opakovatelnosti měření se snahou o maximální eliminaci chyby. Pro měření rozměrů aorty (mm) a velikosti plochy true a false lumen (mm2) byla definována tři anatomická místa v průběhu sestupné hrudní aorty, a to v oblasti horní části – 5 cm za odstupem AS sin, střední části sestupné hrudní aorty – 13 cm za odstupem AS sin a dolní části 7 cm nad odstupem a. celiaca. Pro sledování rozměrů břišní aorty byla zvolena oblast břišní aorty bezprostředně pod odstupy renálních tepen. Všechna měření byla prováděna v programu, který umožňuje přesné, na osu aorty kolmé měření v předdefinované vzdálenosti od určených anatomických bodů (obr. 6).
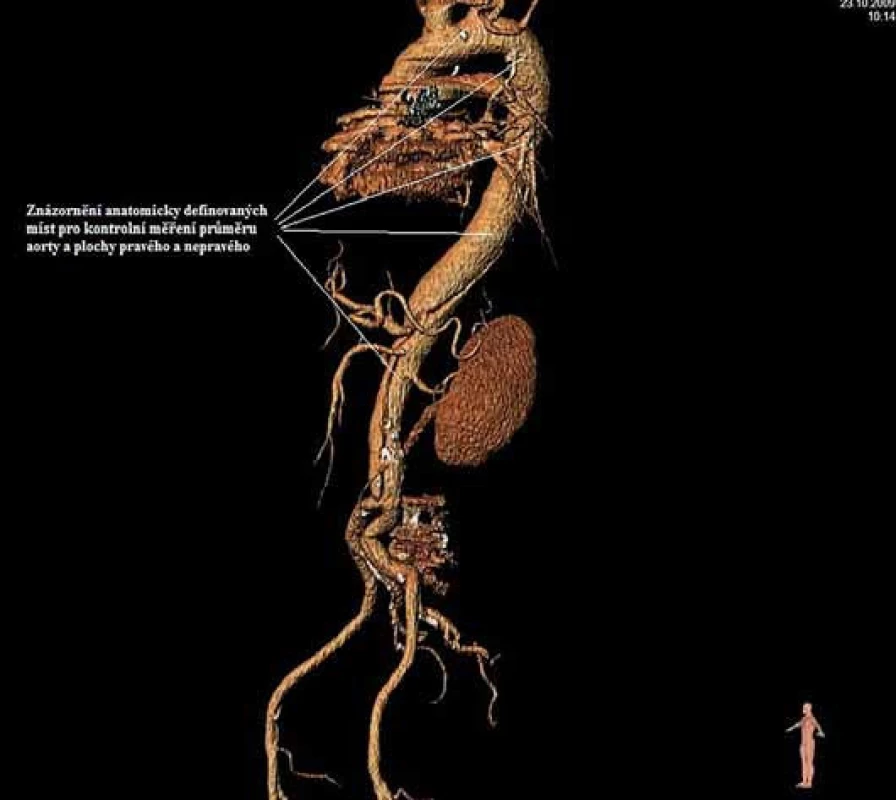
Měření průměru aorty probíhalo manuálním obkreslením kolmé plochy aorty v určeném bodě s následným přepočtem plochy na průměr aorty podle vzorce: d = (√plocha / π) × 2. Po určení průměru aorty se manuálně obkreslila plocha true lumen a opět z důvodu maximální eliminace chyby bylo ve všech případech false lumen dopočítáno jako rozdíl plochy aorty minus plocha true lumen. Tímto systémem měření jsme se snažili dosáhnout maximální eliminace chyby vyplývající z měření v odlišných bodech aorty při kontrolních měřeních a taktéž maximálně eliminovat chybu vyšetřujícího při měření průměrů aorty a ploch pravého a falešného kanálu. Pro falešný a pravý kanál jsme místo hodnoty průměru užili hodnoty plochy z důvodu jejich různého tvaru, který se velmi problematicky vyjadřuje lineární hodnotou průměru.
Digitální subtrakční angiografie
DSA byla vždy provedena jako diagnostický výkon u pacientů s předpokládanou léčbou stentgraftem a vždy byla spojena s provedením selektivní koronarografie (SKG) z důvodu jednak stratifikace rizikovosti pacienta vzhledem k zamýšlenému vý- konu a jednak pro potenciální nebezpečí konverze endovaskulárního výkonu na výkon otevřený při selhání endovaskulární procedury či při závažných komplikacích během výkonu. Za základě našich zkušeností můžeme konstatovat, že DSA spolu s proměřením tlakových gradientů v různých etážích aorty, pravého a falešného lumen, nejlépe objasní plnění jednotlivých větví aorty z pravého či falešného kanálu a taktéž v určení místa obstrukce v cévním řečišti. Na druhé straně muže být zdrojem falešně negativních nálezů u disekcí, které postihují jen omezenou část aorty, např. omezenou část sestupné hrudní aorty, u kterých není přítomno reentry, a tudíž není dostatečný průtok falešným kanálem.
Transezofageální ultrasonografie (TEE)
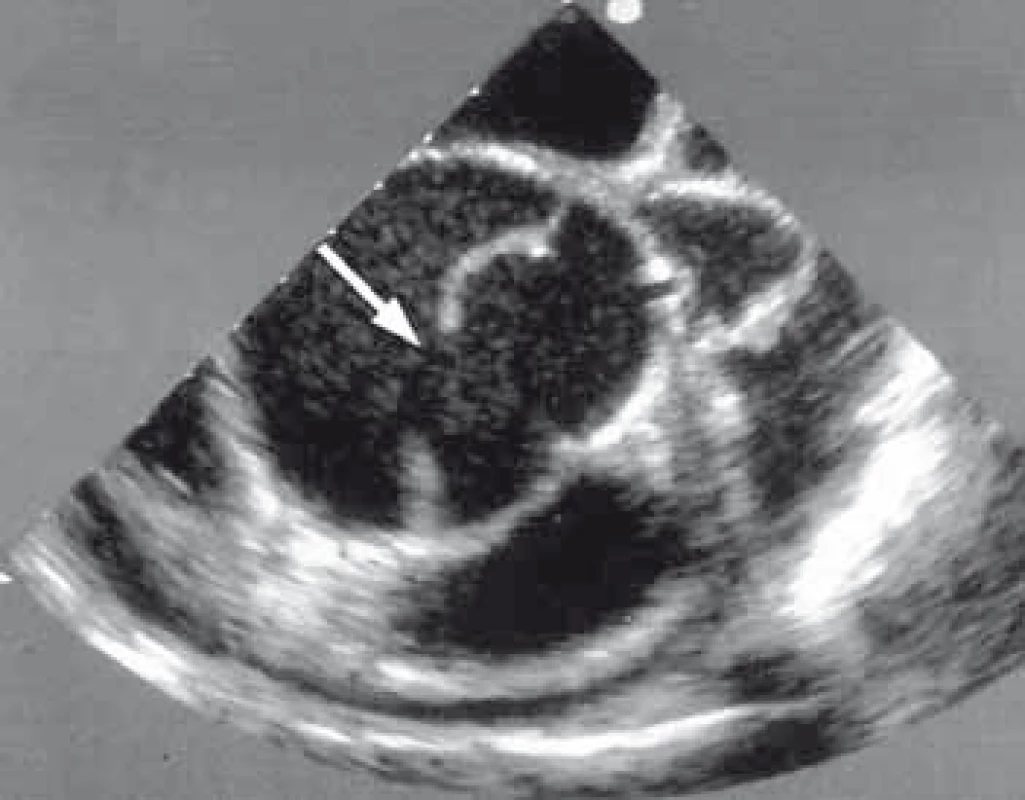
TEE má nezastupitelnou úlohu v diagnostice, plánování a kontrole výsledku implantace stentgraftu [6,7]. Je suverénní metodou na detekci primárního entry (obr. 7) a přítomnost reentry v oblasti sestupné hrudní aorty mezi levou podklíčkovou tepnou a ledvinnými tepnami. Další neocenitelnou informací této metody je ozřejmění charakteru chování pravého a nepravého lumina během srdečního cyklu, kdy je možné zachytit dynamický kolaps pravého lumen z důvodu útlaku false lumen v diastole. Tento stav může být zodpovědný za jinak těžko detekovatelný obraz dynamické obstrukce větví aorty. TEE nám tímto identifikuje pacienty s rizikem úplného kolapsu pravého lumen, to znamená pacienty rizikové, a tudíž vhodné k aktivní formě léčby. TEE bylo taktéž základní vyšetření, které nám určovalo, jak velká část sestupné hrudní aorty má být stentgraftem ošetřena, aby v dalším průběhu onemocnění nedošlo ke vzniku endoleaku v oblasti sestupné hrudní aorty z důvodu retrográdního toku do false lumen přes nepokryté reentry pod implantovaným stentgraftem. Máme zkušenost, že malé reentry vzniklé z důvodu odtržení interkostálních tepen nevede k endoleaku a k retrográdnímu plnění false lumen.
MR angiografie
Její využití u diagnostiky a plánování léčby je podobné jako při CT. Jejími výhodami jsou především absence radiační zátěže a minimální riziko kontrastní nefropatie, nevýhodami především podstatně horší dostupnost, malá zkušenost lékařské veřejnosti s využitím MRA v rámci tohoto onemocnění a delší doba vyšetření. Pro kontrolní vyšetření je hlavní limitací jednak relativní kontraindikace vyšetření u pacientů s implantovaným graftem, jehož skelet je tvořen ocelovým materiálem, a malá výpovědní hodnota vyšetření z důvodu artefaktů, které vyvolává feromagnetický materiál. V našem sledování byla MRA využívána pouze výjimečně, a to u pacientů s pokročilou renální insuficiencí a u pacientů s implantovaným stentgraftem se skeletem z nitinolu, kteří odmítli standardní CTA.
Intravaskulární ultrazvuk
Význam intravaskulárního ultrazvuku je podobný jako význam TEE – zhodnocení dynamiky chování pravého a falešného lumen, a to hlavně v místě, které již nelze zobrazit metodou TEE – tj. v místě břišní aorty a ilického řečiště a taktéž v oblasti aortálního oblouku, který je metodou TEE těžko zobrazitelný. Intravaskulární ultrasonografie je na našem pracovišti nedílnou součástí diagnostické DSA u pacientů s disekcí typu B.
Materiál a technika implantace stentgraftu
Cílem endovaskulární léčby disekcí hrudní aorty typu B je překrytí primárního entry tear s navozením trombózy falešného kanálu v oblasti sestupné hrudní aorty, zpevnění a stabilizace falešného kanálu se zabráněním následné dilatace aorty (obr. 8). Plánování vlastního výkonu – implantace stentgraftu do oblasti primárního entry – stejně jako plánování typu a délky stentgraftu se děje na základě všech vyjmenovaných vyšetření, kde vedoucí roli hraje v dnešní době spirální CTA.
Pacienti, kteří podstoupili endovaskulární výkon, byli k výkonu připraveni podobně jako ke standardnímu cévně chirurgickému výkonu. Bylo provedeno základní biochemické vyšetření a vyšetření hemokoagulace, vyšetření krevní skupiny a nakříženy skupinové krve. Všichni pacienti podstoupili CTA a DSA celé aorty, která byla spojena s vyšetřením selektivní koronarografie. Pacientům před výkonem nebyla vysazena jejich chronická antihypertenzní ani protidestičková léčba. Proximální průměr graftu jsme volili o 10–25 % větší, než je referenční průměr proximálního krčku. Distální průměr stentgraftu jsme volili podle průměru true lumen v místě předkládaného konce graftu. Vzhledem k malému průměru true lumen v místě distálního konce graftu byl ve 14 případech implantován buď jeden kónicky se zužující stentgraft, tzv. tapered design graft, nebo na tubulární graft navazoval graft konický. Tímto jsme předcházeli deformaci distálního konce stentgraftu při velkém nepoměru průměru graftu a průměru true lumen. Tato taktika má dle našich zkušeností velký vý- znam v prevenci perforace intimal flap distálním koncem stentgraftu v dalším průběhu onemocnění. Délku stentgraftu jsme plánovali tak, aby byl kotven do oblasti nepostižené aorty, většinou mezi odstup levostranné společné krkavice a podklíčkové tepny, a aby pokryl jak primární entry, tak všechny další významné reentry dle TEE mezi levou podklíčkovou tepnou a bránicí.
Endovaskulární výkon se prováděl v celkové, lokální či epidurální anestezii v závislosti na celkovém stavu pacienta a přidružených onemocněních. Pacienti byli během výkonu plně antikoagulováni nefrakcionovaným heparinem a byla jim podána preventivní dávka antibiotika penicilinové či cefalosporinové řady. Byly monitorovány základní vitální funkce – EKG, invazivní měření TK, saturace. Jako nejčastější přístup do cévního řečiště jsme volili společnou femorální tepnu (AFC). Po zvolení přístupové cesty pro zavedení stentgraftu byla vypreparována společná stehenní tepna v takovém rozsahu, aby umožnila pod kontrolou zraku bezpečné zavedení 22–24F instrumentária. Od roku 2009 jsme u některých pacientů volili perkutánní zavedení stentgraftu s uzávěrem místa kanylace dvěma systémy Prostar XL či Perclose ProGlide. Po zavedení angiografického katetru z kontralaterálního třísla k provádění kontrolních angiografií byla provedena pod kontrolou zraku punkce vypreparované společné stehenní tepny se zavedením 8–10F zavaděče. Přes zavaděč za pomocí angiografického katetru je umístěn do oblasti vzestupné aorty pevný ultra či super stiff 0,035–0,038 vodič, který se většinou svým koncem opírá o aortální chlopeň. V některých případech k zajištění optimální podpory pro zavedení stentgraftu procházíme přes aortální chlopeň do levé srdeční komory. Zde je však bezpodmínečně nutná monitorace pacienta se zajištěním možnosti řešení maligních arytmií vyprovokovaných drážděním vodičem. Buď přímo, nebo po šetrné aterotomii je proniknuto zaváděcím systémem do oblasti proximální kotvicí zóny. Následuje kontrolní angiografie s korekcí pozice stentgraftu a postupné uvolnění ze zavádějícího systému. Před vlastní implantací je nutné snížit systémový tlak na hodnoty kolem 60–70 mm Hg systolického tlaku k zabránění migrace stentgraftu během vypouštění. Do roku 2005 jsme k tomuto účelu užívali parenterálně podávané nitráty. Od roku 2005 užíváme systém pravokomorové stimulace, kdy z jugulárního přístupu dočasnou komorovou stimulací o frekvenci 160–200/min dosahujeme kontinuálního snížení tlaku na hodnoty kolem 60 mm Hg. Velkou výhodou této metody je vyvarování se nekontrolovaných hypotenzí a následných hypertenzí při užití parenterálních farmak. Po uvolnění stentgraftu v optimální pozici je provedena kontrolní angiografie a následně TEE k průkazu dobře rozepnutého graftu a vyloučení endoleaku. Při TEE obraze úplného rozepnutí stentgraftu a známkách trombotizace falešného kanálu v oblasti sestupné hrudní aorty neprovádíme modulaci stentgraftu latexovým balonkem, aby nedošlo k iatrogenímu natržení intimal flap a vzniku nové komunikace mezi oběma kanály. Pokud je detekovatelný proximální typ endoleaku, provede se při snížení systémového tlaku dodilatace a modulace stentgraftu v oblasti proximální kotvicí zóny. Následuje kontrolní angiografie břišní aorty a pánevního řečiště k vyloučení útlaku či nedostatečného plnění viscerálních, ledvinných a končetinových tepen. Výkon je ukončen suturou arteriotomie a třísla a dle rozhodnutí cévního chirurga je neutralizován heparin protamin sulfátem. Pacient je odeslán na jednotku intenzivní péče k sledování vitálních funkcí. Nejčastější komplikace provázející implantaci stentgraftů shrnuje tab. 1.

Na jednotce kardio-angiologické intenzivní péče jsou u pacienta monitorovány vitální funkce, neprodleně po odeznění celkové či epidurální anestezie je provedeno neurologické vyšetření k vyloučení rozvoje spinální ischemie a tlakové hodnoty u pacienta jsou kontrolovány v pásmu normotenze. Kontrolní neurologické vyšetření je indikováno u pacientů taktéž 2. a 3. pooperační den, pro možnost odloženého rozvoje příznaků spinální ischemie [8–10]. Během pobytu na JIP jsou sledovány základní vitální funkce, hemogram, koagulace, pacient je na preventivní dávce nízkomolekulárního heparinu z důvodu prevence trombembolické nemoci. Po stabilizaci vitálních funkcí a zrušení drénů je nekomplikovaný pacient v průměru 2.–3. den přeložen na standardní jednotku.
Na standardní jednotce je pacient intenzivně rehabilitován a je mu pravidelně kontrolována a upravována antihypertenzní medikace. Při nekomplikovaném průběhu je propuštěn 6.–7. den. Před propuštěním se provádí kontrola rány po chirurgickém přístupu a kontrolní CTA celé aorty k zhodnocení úspěšnosti léčby. Na základě našich dlouhodobých zkušeností s hrudními stentgrafty, kdy jsme u dvou pacientů prokázali infekci protézy s odstupem tří a pěti let po implantaci, doporučujeme pacientům stejnou antibiotickou profylaxi jako u pacientů s umělými chlopňovými náhradami.
Řešení ischemických komplikací aortálních disekcí
V rámci komplexní péče o pacienty s disekcí aorty typu B je třeba se taktéž zmínit o ischemických komplikacích, které provázejí toto onemocnění, a o možnostech jejich řešení. Z registrů aortálních disekcí vyplývá, že klinický průběh aortální disekce typu A i B je až u jedné třetiny pacientů komplikován rozvojem orgánové ischemie. Jednotlivé orgány jsou postiženy následovně: ledviny 8 %, játra 5 %, dolní končetiny 24 % [11]. Pokud jsou přítomny klinicky významné projevy orgánové ischemie, podstatně se zhoršuje prognóza pacienta a hospitalizační mortalita stoupá nad 50 % [12]. Je tedy nutné po počátečních příznacích orgánové ischemie aktivně pátrat a být připraveni na jejich účinnou léčbu.
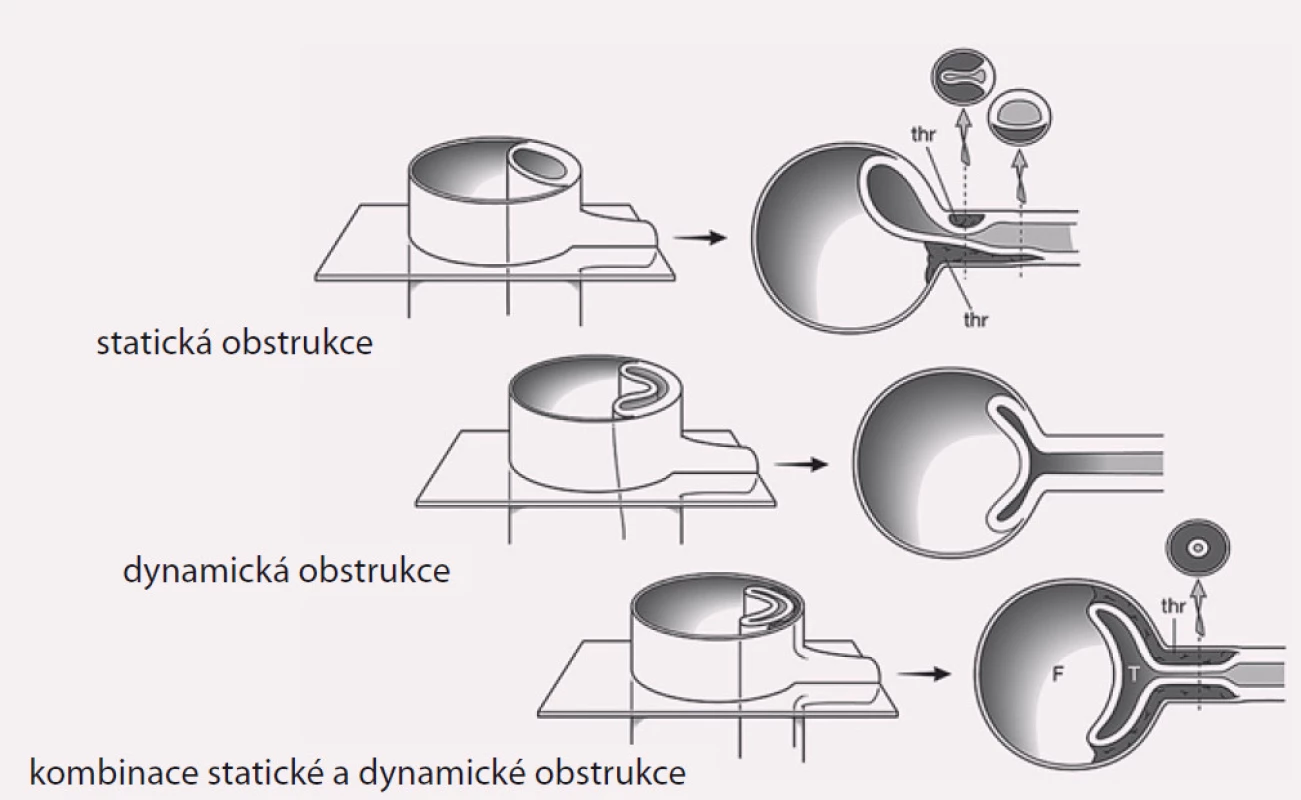
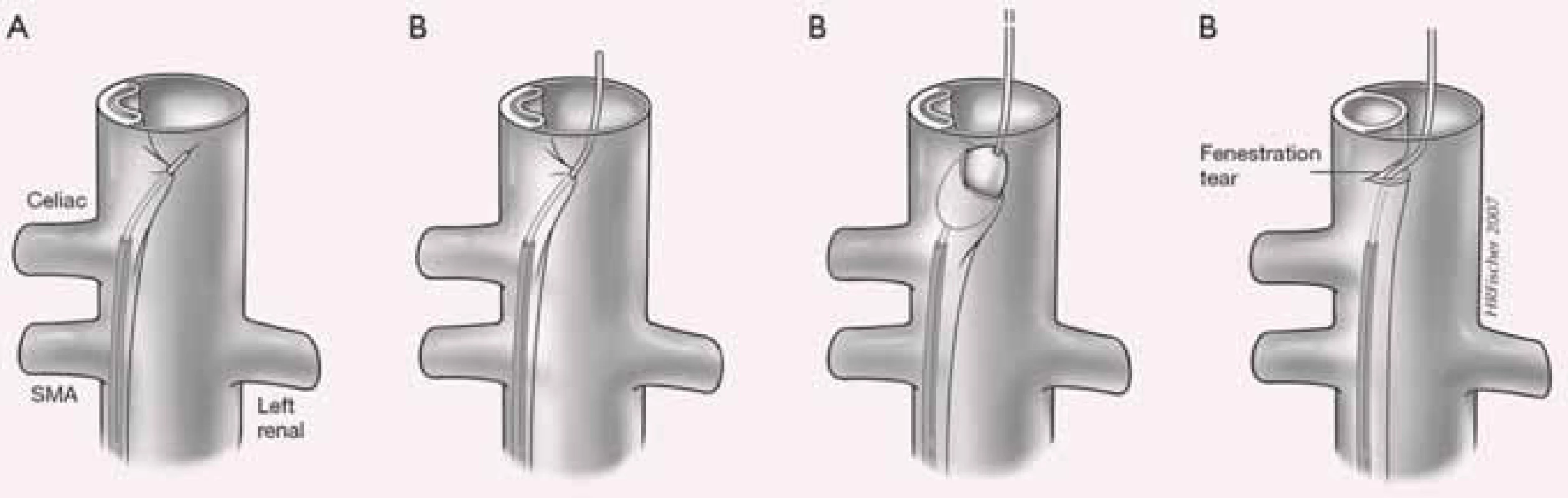
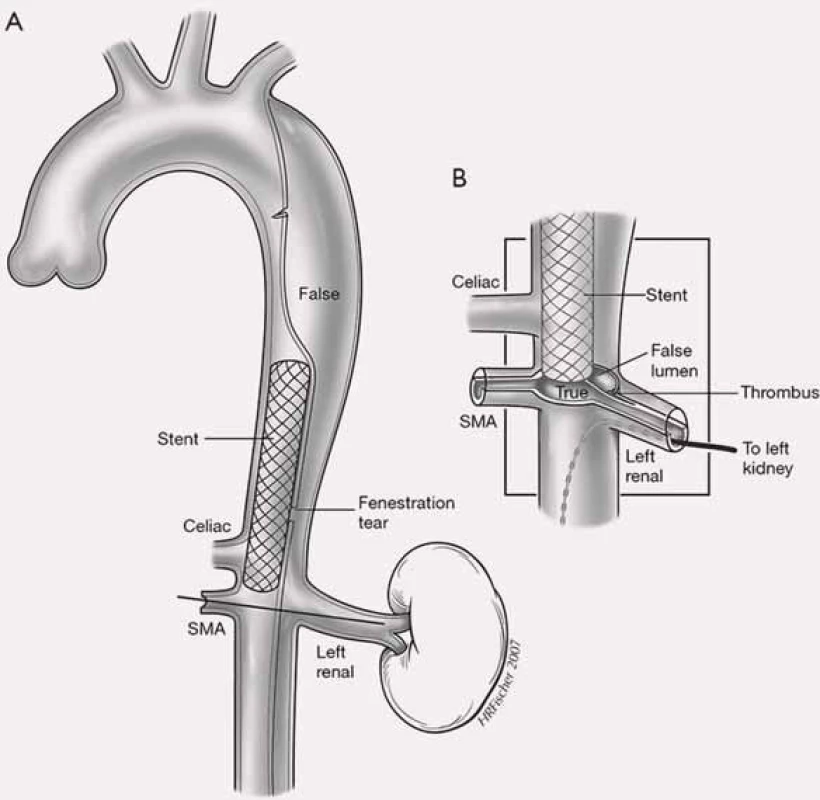
Projevy orgánové ischemie jsou dány nedostatečným zásobením příslušných orgánů z důvodu statické či dynamické obstrukce mobilním intimal flapem, který buď intermitentně, či trvale zužuje či úplně uzavírá aortální větve (obr. 9). Prvotním léčebným úkonem při rozvoji statické či dynamické obstrukce je překrytí primárního entry implantací stentgraftu a vyřazení falešného kanálu z oběhu, čímž dosáhneme zlepšení perfuze pravého kanálu, a většina takto vzniklých obstrukcí sama odezní. Někdy i přes ošetření primárního entry však nemusí k odeznění statické obstrukce dojít. V těchto případech je poté jedinou možností, pokud pomineme zatěžující chirurgické spojkové operace, provedení implantace stentu s obnovením průtoku tepnou (obr. 10). Z našich zkušeností doporučujeme implantovat stenty spíše delší, které je nutné kotvit ve zdravé části utlačované tepny, aby se předešlo progresi disekce do nitra tepny a také překlopení slepého chobotu disekce přes konec stentu s opětovným uzávěrem tepny.
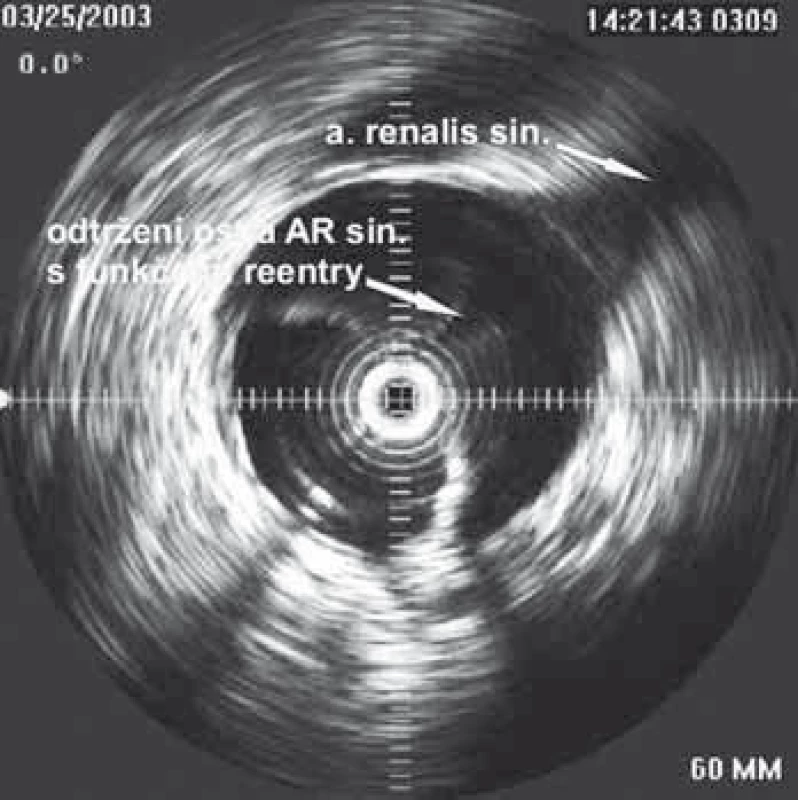
Dalším možným mechanizmem vzniku nedokrevnosti orgánů či končetin při aortální disekci je útlak odstupu tepen mobilním intimal flapem. Velmi často jsme při vyšetření intravaskulárním ultrazvukovým sonografem (IVUS) detekovali cirkulárně odtržený odstup renální tepny při rozepjatém jak pravém, tak falešném kanálu (obr. 11). Přes toto funkční reentry se dostatečně plnil jak falešný kanál, tak i ledvina, což jsme opakovaně potvrdili jak dopplerovským vyšetřením ledvinných tepen, tak provedenou dynamickou scintigrafií ledvin. Tyto funkční reentry, které jsou velmi často přítomny právě v oblasti odstupu velkých tepen abdominální aorty – a. celiaca, AMS a ledvinných tepen – jsou zodpovědné za dostatečné plnění viscerálních orgánů, ale na druhé straně jsou důvodem, proč u pacientů v následném období nedochází k trombóze falešného kanálu v oblasti abdominální aorty. Možný kolaps pravého lumen si vysvětlujeme především nepřítomností dostatečně velkého, a tím funkčního reentry, kdy více poddajné falešné lumen je primárně lépe plněno než rezistentní pravé lumen, a na základě tlakového gradientu mezi oběma kanály dojde ke kolapsu pravého lumen. Zde pokus o fenestraci intimal flap (obr. 12) či lokální implantace stentu do oblasti true lumen (obr. 13) většinou nezabezpečí dostatečný průtok krve pravým kanálem a může dojít ke kolapsu stentu.
Je zřejmé, že jedině komplexní přístup s využitím různých vyšetřovacích procedur, přesné určení místa primárního entry, přítomných reentry a podrobná a přesná lokalizace místa obstrukce může velmi účinně ovlivnit rozvoj a léčbu závažných, život ohrožujících ischemických komplikací provázejících aortální disekce.
Výsledky léčby
K endovaskulární léčbě byli indikováni pacienti splňující kritéria tzv. high risk patient, tj. pacienti s projevy ischemie viscerálních orgánů či končetinové ischemie v akutní či chronické fázi onemocnění, pacienti s dilatací sestupné hrudní aorty nad 50 mm a pacienti s rychlou progresí dilatace aorty více než 10 mm/rok. Vzhledem k výsledkům studie INSTEAD, která byla prozatím jedinou randomizovanou multicentrickou studií srovnávající pacienty se stabilní, nekomplikovanou disekcí aorty typu B léčených implantací stentgraftu či intenzivní medikamentózní terapií a která neprokázala benefit endovaskulární léčby oproti léčbě konzervativní [13], léčíme na našem pracovišti pouze případy spojené s projevy akutní ischemie. Je možné, že v blízké budoucnosti budou indikace k aktivní léčbě nekomplikovaných pacientů s disekcí typu B přehodnoceny na základě výsledků dlouhodobého sledování pacientů studie INSTEAD XL, která byla pokračováním studie INSTEAD a která prokázala snížení jak celkové mortality, tak mortality spojené s aortální disekcí v dlouhodobém sledování nekomplikovaných pacientů léčených implantací stengraftu oproti pacientům léčeným konzervativně [14]. Námi sledovaní pacienti byli rozděleni do souboru pacientů léčených do 12 měsíců od vzniku disekce a na soubor pacientů léčených po 12. měsíci od vzniku disekce.
Hodnocení souboru pacientů (do 12 měsíců)
Hodnocení souboru pacientů léčených implantací stentgraftu do oblasti primárního entry v časovém období do 12 měsíců od vzniku onemocnění. U souboru pacientů léčených do 12 měsíců od vzniku disekce v oblasti sestupné hrudní aorty byl zjištěn statisticky významný rozdíl celkového průměru aorty mezi hodnotami na začátku sledování a hodnotami po 12 měsících (p = 0,0355), po 24 měsících (p = 0,0186) a po 36 měsících (p = 0,0154), a to ve smyslu zmenšení průměru hrudní aorty (graf 1). Mezi hodnotami po 24 měsících a 36 měsících už rozdíl nebyl statisticky významný.

U souboru pacientů léčených do 12 měsíců od příhody v oblasti břišní aorty nebyl zjištěn statisticky významný rozdíl celkového průměru aorty v oblasti břišní aorty mezi hodnotami na začátku sledování a hodnotami po 12–36 měsících (graf 2).

Hodnocení souboru pacientů (po 12. měsíci)
Hodnocení souboru pacientů léčených implantací stentgraftu do oblasti primárního entry v časovém období po 12. měsíci od vzniku onemocnění. U souboru pacientů léčených po 12. měsíci od vzniku disekce v oblasti sestupné hrudní aorty nebyl zjištěn statisticky významný rozdíl mezi hodnotami na začátku sledování a hodnotami po 12 měsících, které se týkají změny celkového průměru sestupné hrudní aorty, významný rozdíl byl zjištěn až po 24 měsících (p = 0,0356 v případě jednostranné hyp.) a po 36 měsících (p = 0,0043), a to ve smyslu zmenšení celkového průměru sestupné aorty. Významný rozdíl byl také zjištěn mezi hodnotami po 24 měsících a 36 měsících (p = 0,0396) (graf 3).

U souboru pacientů léčených po 12. měsíci od vzniku disekce v oblasti břišní aorty nebyl zjištěn statisticky významný rozdíl mezi hodnotami průměru celkové šíře břišní aorty na začátku sledování a hodnotami po 12–36 měsících (graf 4).

Z celkového souboru 48 pacientů léčených implantací stentgraftu do oblasti primárního entry v letech 2000–2014 dokončilo sledování celkem 38 pacientů (79,2 %). Průměrná doba sledování souboru byla 88,3 (6–168) měsíce, průměrná doba trvání onemocnění byla 99,4 (1–196) měsíce. Zastoupení pohlaví muži/ženy bylo v poměru 39: 9, tj. v 81,2 % převládalo mužské pohlaví. Dva pacienti byli z evidence ztraceni po čtyřech a šesti letech sledování a osm pacientů zemřelo v průběhu sledování. Ve čtyřech případech byl příčinou úmrtí nově vzniklý novotvar, u jednoho pacienta srdeční selhání po náhradě aortální chlopně pro významnou aortální insuficienci, jeden pacient zemřel na krvácení do mozku při chronické antikoagulační terapii, jeden na bronchopneumonii a jeden do 24 hod po implantaci stengraftu na multiorgánové selhání z důvodu proběhlé těžké ischemie viscerálních orgánů a dolních končetin. Celková mortalita našeho souboru je tedy 8: 46, tj. 17,4 %. Mortalita spojená s aortální disekcí je poté 1: 46, tj. 2,2 %.
Statickou obstrukci viscerálních a ledvinných tepen s projevy orgánové ischemie jsme řešili celkem u šesti pacientů, a to provedením stent PTA renálních tepen v pěti případech, u dvou případů byl stent implantován do odstupu AMS a a. celiaca. Ve všech 48 případech se nám podařilo zavést stentgraft do místa určení, v 34 případech byl překryt odstup AS sin. U všech pacientů se v průběhu hospitalizace objevil „postimplantační syndrom“ charakterizovaný přechodným vzestupem teploty, lehkou leukocytózou a elevací CRP. K normalizaci CRP došlo až v šestém měsíci po zavedení stentgraftu (graf 5).

Z technických komplikací došlo ve čtyřech případech ke kolapsu stentgraftu (staré, nedokonalé, „home made“ grafty implantované v počátku našeho sledování) a 1× k hemodynamicky nevýznamné perforaci aorty. Všechny tyto komplikace byly úspěšně vyřešeny implantací dalšího stentgraftu či implantací balon expandabilního stentu. Z dalších periprocedurálních komplikací uvádíme 1× překrytí odstupu ACC sin s nutností provedení akutního karoticko-karotického bypassu bez rozvoje mozkové ischemie, u jednoho pacienta se v pooperačním období objevily středně závažné projevy nedokrevnosti levé horní končetiny vyžadující provedení karotiko-subklaviální transpozice. V devíti případech (18,7 %) musela být provedena reintervence, většinou implantace extenze z důvodu perforace intimal flap na dolním konci stentgraftu, či implantace stentu do zkolabovaného stentgraftu. Jednou byla provedena embolizace AS sin k zamezení zpětnému toku do oblasti falešného kanálu z oblasti levé podklíčkové tepny. V jednom případě došlo k ruptuře sestupné hrudní aorty nad bránicí po 21 měsících od úspěšné implantace stentgraftu, která byla úspěšně řešena chirurgickou torakoabdominální náhradou. Ani v jednom případě jsme u aortální disekce typu B léčené zavedením stengraftu nedetekovali rozvoj obávané spinální ischemie.
Akutní úspěšnost procedury, kterou jsme hodnotili jako trombózu false lumen v oblasti sestupné hrudní aorty v čase propuštění z nemocnice, byla v našem souboru 43: 48, tj. 89,6 %. Dlouhodobá úspěšnost léčby, kterou jsme hodnotili jako trombózu false lumen sestupné aorty na konci sledování jednotlivého pacienta, byla 48: 48, tj. 100 %, což znamená, že přídatnými procedurami se nám u všech našich pacientů podařilo dosáhnout trombózy false lumen v oblasti sestupné hrudní aorty. Pouze u pěti pacientů (10,4 %) došlo ke kompletní trombóze false lumen v oblasti přítomné disekce.
Závěr
Na základě našich dlouholetých zkušeností hodnotíme endovaskulární léčbu disekcí aorty typu B Stanfordské klasifikace jako léčbu vysoce účinnou, s minimálním rizikem komplikací. Hlavní výhodou oproti léčbě chirurgické je její miniinvazivnost a především malá pravděpodobnost rozvoje spinální ischemie. Endovaskulární léčba disekcí hrudní aorty typu B Stanfordské klasifikace se dle dostupných střednědobých výsledků zdá nadějným a bezpečným typem léčby selektované skupiny pacientů. Trombózou falešného kanálu v oblasti sestupné hrudní aorty dochází k její remodelaci a stabilizaci se zabráněním následné dilatace, a to nejenom v oblasti sestupné hrudní aorty, ale i v oblasti aorty břišní, kde většinou přetrvává perfuze false lumen. Zlepšením perfuze pravého lumen dochází k prevenci či odstranění ischemie viscerálních větví břišní aorty a končetinových tepen.
Doručeno do redakce: 7. 8. 2016
Přijato po recenzi: 19. 8. 2016
MUDr. Dušan Kučera, Ph.D.
nemocnicevitkovice.agel.cz
dusan.kucera@vtn.agel.cz
Zdroje
1. Griepp RB, Ergin MA, Galla JD et al. Natural history of descending thoracic and thoracoabdominal aneurysms. Ann Thorac Surg 1999; 67: 1927–1930.
2. Hagan PG, Nienaber CA, Isselbacher EM et al. The International Registry of Acute Aortic Dissection (IRAD) – new insights into an old disease. JAMA 2000; 283: 897–903.
3. Hata H, Shiono M, Inoue T et al. Optimal treatment of type B acute aortic dissection: long-term medical follow-up results. Ann Thorac Surg 2003; 75: 1781–1784.
4. Hsu RB, Ho YL, Chen RJ et al. Outcome of medical and surgical treatment in patients with acute type B aortic dissection. Ann Thorac Surg 2005; 79: 790–794.
5. Nienaber CA, Fattori R, Lund G et al. Nonsurgical reconstruction of thoracic aortic dissection by stent-graft placement. N Engl J Med 1999; 340: 1539–1545.
6. Lee DY, Williams DM, Abrams GD. The dissected aorta. part II. Differentiation of the true from the false lumen with intravascular US. Radiology 1997; 203: 32–36.
7. Schutz W, Gauss A, Meierhenrich R et al. Transesophageal echocardiographic guidance of thoracic aortic stent-graft implantation. J Endovasc Ther 2002; 9 (Suppl 2): 14–19.
8. Kato N, Shimono T, Hirano T et al. Midterm results of stent-graft repair of acute and chronic aortic dissection with descending tear: the complication specific approach. J Thorac Cardiovasc Surg 2002; 124: 306–312.
9. Parodi JC, Palmaz JC, Barone HD. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991; 5: 491–499.
10. Swee W, Dake MD. Endovascular management of thoracic dissections. Circulation 2008; 117: 1460–1473. doi: 10.1161/CIRCULATIONAHA.107.690966.
11. Geirsson A, Szeto WY, Pochettino A et al. Significance of malperfusion syndromes prior to contemporary surgical repair for acute type A dissection: outcomes and need for additional revascularizations. Eur J Cardiothorac Surg 2007; 32: 255–262.
12. Garrett HE Jr., Wolf BA. Management of acute infrarenal aortic occlusion secondary to type A dissection. Ann Thorac Surg 2006; 81: 1500–1502.
13. Nienaber CA, Zannetti S, Barbieri B et al. INSTEAD Study Collaborators. INvestigation of STEnt grafts in patients with type B Aortic Dissection: design of the INSTEAD trial: a prospective, multicenter, european randomized trial. Am Heart J 2005; 149: 592–599.
14. Nienaber CA, Kische S, Rousseau H et al. Endovascular repair of type B aortic dissection long-term results of the randomized investigation of stent grafts in aortic dissection trial. Circ Cardiovasc Interv 2013; 6: 407–416. doi: 10.1161/CIRCINTERVENTIONS.113.000463.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2016 Číslo 3
Nejčtenější v tomto čísle
- Betablokátory, které nejméně negativně ovlivňují kardiorespirační zdatnost u zdravých osob
- Endovaskulární léčba ileofemorální hluboké žilní trombózy
- Možnosti endovaskulární léčby akutní končetinové ischemie
- Disekce aorty typu B s těžkou viscerální a končetinovou ischemií řešená kompletní endovaskulární revaskularizací – kazuistika
