Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
Long-term left ventricular assist devices in heart failure treatment
Heart transplantation remains the gold standard therapy for patients with advanced heart failure. However, long-term left ventricular assist devices (LVAD) became the standard therapy because of the limited number of usable donor grafts and long waiting times. In this paper, we will summarise the history, evolution and function of LVADs. We will also present a review of complications and some specific clinical characteristics of patients with implanted LVAD. Three types of LVADs with continual flow are currently implanted in the Czech Republic: the second-generation LVAD with HeartMate II (Thoratec, USA) axial pump, third-generation LVAD with HeartWare HVAD (Heartware, USA) centrifugal pump, and as a part of clinical trials the newest third generation pump HeartMate III (Thoratec, USA), which is able to generate an artificial pulse. LVADs are already used in Czech Republic as a standard therapy for patients on the waiting list as a bridge to heart transplant. However, in future LVADs will be used for permanent implantation – destination therapy.
Keywords:
mechanical circulatory support – left ventricular assist devices
Autoři:
V. Horváth; P. Němec; J. Ondrášek; H. Bedáňová; P. Fila; P. Pokorný; P. Pavlík; J. Slavík; R. Wagner
Působiště autorů:
Centrum kardiovaskulární a transplantační chirurgie, Brno
Vyšlo v časopise:
Kardiol Rev Int Med 2016, 18(4): 253-257
Souhrn
Transplantace srdce zůstává zlatým standardem v léčbě pacientů s pokročilým srdečním selháním. Vzhledem k limitovanému počtu použitelných srdečních graftů a dlouhým čekacím dobám se však dlouhodobé levokomorové srdeční podpory (left ventricle assist device – LVAD) staly standardní terapií. Ve sdělení shrnujeme historii, vývoj a funkci LVAD. Uvádíme i přehled komplikací a některá klinická specifika pacientů s implantovaným LVAD. V České republice jsou v současnosti implantovány tři typy LVAD s kontinuálním průtokem. LVAD druhé generace s axiální pumpou HeartMate II (Thoratec, USA), LVAD třetí generace s centrifugální pumpou HeartWare HVAD (Heartware, USA) a v rámci klinických zkoušek nejnovější pumpa třetí generace HeartMate III (Thoratec, USA), jež je schopna vytvářet arteficiální pulz. LVAD terapie se již v ČR stala standardem u pacientů na čekací listině jako most k transplantaci srdce, vývoj však spěje jednoznačně i k použití pro trvalou implantaci – destinační terapii.
Klíčová slova:
mechanická podpora oběhu – levokomorová srdeční podpora
Úvod
Transplantace srdce je v současnosti léčbou volby pro vybrané pacienty v terminální fázi srdečního selhání (SS), za posledních 40 let jich bylo provedeno přes 85 000 ve více než 249 centrech na celém světě [1]. Významný vědecký pokrok a řada inovací v této oblasti však nemohou vyřešit dva současné zásadní problémy srdečních transplantací – neustále narůstající počet pacientů se SS při klesajícím počtu použitelných dárcovských orgánů.
Trvalý nedostatek dárcovských orgánů vedl k rozvoji alternativních metod, a to zejména mechanické srdeční podpory (MSP) nejen jako mostu k transplantaci srdce (bridge to transplantation – BTT), ale i jako destinační terapie (DT). Zlepšující se výsledky a zvyšující se trvanlivost levokomorových srdečních podpor (left ventricular assist device – LVAD) vedly k tomu, že dnes již představují etablovanou alternativu pro léčbu pacientů v konečné fázi SS.
Implantační centra zajišťují většinu péče o pacienty s LVAD po implantaci. Vzhledem k postupně se zlepšujícímu přežívání a zvyšujícímu se počtu implantací však počet těchto pacientů stále narůstá, a tak je předpoklad, že se s těmito pacienty budou stále častěji setkávat i lékaři mimo tato centra. Ve sdělení shrnujeme historii, vývoj a funkci LVAD. Uvádíme i některá klinická specifika a přehled možných komplikací pacientů s implantovaným LVAD.
Historie LVAD
Za počátek vývoje MSP lze považovat vývoj válečkové pumpy Micheaelem DeBakey, tehdy ještě studentem medicíny, před 85 lety, který následně umožnil konstrukci Gibbonova prvního přístroje pro mimotělní oběh [2]. Poté následovala velmi dlouhá doba, během které se řada týmů na celém světě snažila v experimentu vyvinout implantovatelnou srdeční podporu nebo umělé srdce. Velkých experimentálních úspěchů dosáhl v 80. letech 20. století i brněnský tým pod vedením prof. Vašků. První pulzatilní LVAD HeartMate XVE (Thoratec, USA) byl schválen v USA jako most k transplantaci srdce v roce 1994 a k destinační terapii v roce 2003. První generace LVAD, která byla schopna generovat pulzatilní tok krve, měla velké rozměry, byla hlučná, měla silné perkutánní vodiče, vysoký počet závažných komplikací a jejich trvanlivost nebyla dostatečná [3–5].
V následujících letech došlo k přechodu od pulzatilního toku k technologii s kontinuálním průtokem. Výhodou přístrojů s kontinuálním tokem je zmenšení rozměrů na sedminu proti předchozí generaci, čtvrtinová hmotnost, tichý chod, tenký perkutánní vodič a výrazně zlepšená trvanlivost. V současnosti jsou celosvětově nejčastěji implantovanými LVAD HeartMate II (Thoratec, USA) – druhá generace s axiální pumpou a HeartWare HVAD (HeartWare, USA) – třetí generace s miniaturizovanou centrifugální pumpou. Tyto přístroje jsou schváleny a implantovány i v ČR. Nejnovější LVAD třetí generace HeartMate III (Thoratec, USA), schopný generovat arteficiální pulz, je implantován v rámci klinických zkoušek.
Základní funkce LVAD
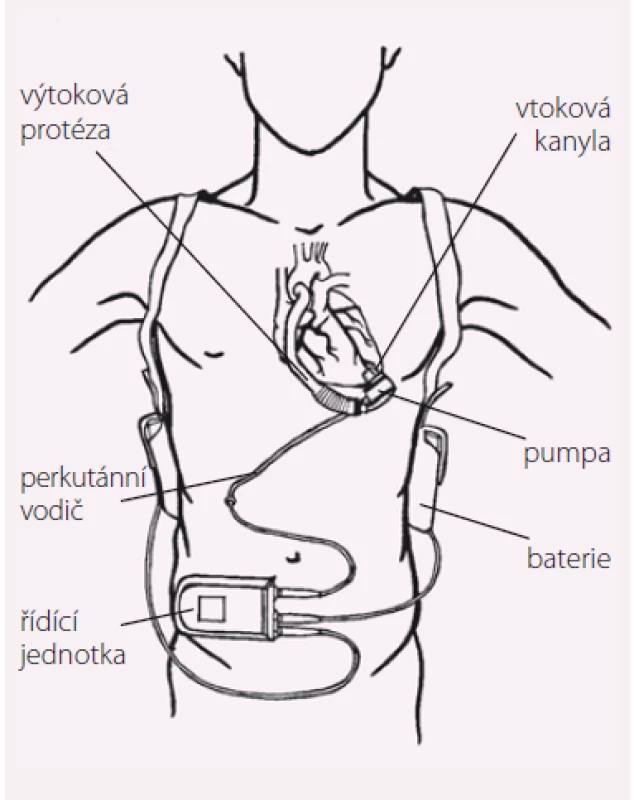
Základní funkční schéma v současnosti implantovaných LVAD je velmi podobné. Na obr. 1 je vyznačeno pět hlavních komponent LVAD: vtoková kanyla, pumpa, výtoková kanyla, perkutánní vodič a elektrická řídicí jednotka. Vtoková (inflow) kanyla je nejčastěji zaváděna přes hrot do levé komory a výtoková (outflow) kanyla je většinou anastomozována k ascendentní aortě. Pumpa aktivně nasává krev z levé komory přes vtokovou kanylu a čerpá jí výtokovou kanylou do aorty. Vlastní pumpa je v závislosti na její velikosti uložena v břišní stěně (HeartMate II) nebo v perikardu (HeartWare HVAD, HeartMate III). Perkutánní vodič spojuje pumpu s řídicí jednotkou a bateriemi, které lze nosit zavěšené přes rameno nebo kolem pasu.
Indikace LVAD
Indikací pro implantaci LVAD je medikamentózně refrakterní SS u nemocných na čekací listině k transplantaci, u kterých není k dispozici vhodný dárce. Hlavním cílem je snížení mortality u pacientů závislých na inotropní podpoře, kde bylo roční přežívání před zavedením MSP pouze 23 % [6]. Neméně významné je však i zlepšení funkčního stavu a kvality života, a to zejména u pacientů s předpokládanou delší čekací dobou při větších rozměrech pacienta, s méně obvyklou krevní skupinou či za přítomnosti anti-HLA protilátek. Dalším benefitem je zvrat (nebo prevence) zhoršování orgánových funkcí, vč. zlepšení plicní hypertenze.
Implantace LVAD je v současnosti v ČR hrazena u pacientů na listině čekatelů transplantace srdce jako most k transplantaci srdce – indikace BTT. Ve většině států Evropské unie (např. i v Chorvatsku) jsou již LVAD indikovány i jako destinační terapie u pacientů, kteří nejsou kandidáty transplantace srdce, v souladu s guidelines Evropské kardiologické společnosti [7].
Zlomem v použití LVAD byla studie REMATCH (Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure) publikovaná v roce 2001, která prokázala zlepšení dlouhodobého přežívání u pacientů s implantovaným LVAD první generace ve srovnání s pacienty s konzervativní terapií srdečního selhání. Po 12 měsících bylo přežívání 52 % u pacientů v LVAD skupině a 25 % u pacientů konzervativně léčených. Po 24 měsících trend pokračoval s přežíváním 23 % v LVAD skupině a 8 % v kontrolní skupině [6]. V současnosti již 2. a 3. generace LVAD dosahují jednoročního přežívání, které je srovnatelné s transplantací srdce (80– 90 %), což podporuje jejich použití jak v indikaci BTT, tak i jako destinační terapie [8,9].
Výběr pacientů a načasování implantace
Implantace LVAD je vždy spojena s určitým rizikem komplikací. Načasování implantace do doby, kdy již pacient bude z implantace profitovat, a dříve, než je již na implantaci příliš pozdě, je klíčové pro úspěch LVAD terapie. Dle největšího registru dlouhodobých mechanických srdečních podpor INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) jsou pacienti zařazeni do sedmi klinických profilů, které umožňují identifikovat rizika spojená s načasováním implantace LVAD (tab. 1) [10–12]. Dle současných dat mají pacienti v INTERMACS profilu 1 (těžký a progredující kardiogenní šok) velmi vysokou mortalitu po implantaci dlouhodobých LVAD a ve většině center, vč. Centra kardiovaskulární a transplantační chirurgie Brno (CKTCH), se u těchto pacientů dává přednost dočasné perkutánní mechanické podpoře oběhu (nejčastěji ECMO) ke stabilizaci oběhu a úpravě orgánových funkcí. Mortalita v INTERMACS profilech 1–2 je až o 44 % vyšší než mortalita pacientů implantovaných v profilech 3–4 [10], proto je snaha o indikaci v těchto časnějších stadiích. Nejčastější kontraindikace implantace LVAD jsou shrnuty v tab. 2.
![Klinické profily INTERMACS. Upraveno dle [12].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/331a0a2a65f55f27bd0987661bec65a6.png)

Pulzace a krevní tlak u pacientů s LVAD
To, zda pacient s LVAD má či nemá hmatný pulz, je ovlivněno řadou faktorů, kromě jiných jde zejména o zbylou kontraktilní rezervu levé komory, rychlost otáček pumpy, systémový tlak krve (afterload pumpy) a tlak krve v levé komoře (preload pumpy). Můžeme se tedy setkat s kompletní škálou nálezů od téměř normálního pulzu přes občas hmatný slabý pulz při intermitentním úplném nebo částečném otevření aortální chlopně až po nehmatný pulz. V praxi to představuje komplikaci pro měření tlaku u těchto pacientů. Při absenci pulzu je používáno měření pomocí Dopplerovské ultrazvukové sondy. Sonda se přikládá na kubitální nebo radiální tepnu a po identifikaci toku je manžeta tlakoměru nafouknuta až do vymizení zvukového signálu. Poté je manžeta pomalu vypouštěna. Hodnota, při které se obnoví tok, odpovídá střednímu tlaku krve. Pravidelné kontroly tlaku krve jsou přitom nezbytné v dlouhodobé péči o pacienty s LVAD. LVAD s kontinuálním průtokem, a zvláště s centrifugální pumpou, jsou velmi citlivé na zvýšení afterloadu, hodnota krevního tlaku tedy přímo ovlivňuje průtok pumpou i vyprazdňování levé komory, otevírání aortální chlopně, mitrální regurgitaci a následně i pravostranné srdeční oddíly. Hypertenze vede u pacientů s LVAD ke zvýšenému výskytu mozkových příhod, ischemických i hemoragických, a zvýšenému riziku pravostranného SS [13,14]. Hypertenzi u těchto pacientů definujeme jako střední tlak krve vyšší než 80 mm Hg, léčba je obdobná jako u pacientů se SS. K léčbě by se primárně měly použít ACE inhibitory nebo blokátory receptorů pro ATII za pečlivé kontroly renálních funkcí a betablokátory za monitorace funkce pravé komory [13].
Komplikace
Selhání pravé komory
Perioperační selhání pravé komory po implantaci LVAD je závažnou komplikací, v literatuře je popisovaná mortalita dosahující 19–43 % [3,4]. Nejčastěji uváděnou příčinou selhání pravé komory je posun mezikomorového septa doleva při unloadingu levé komory pumpou. Dochází k deformaci a dilataci pravé komory a následnému snížení její kontraktility. Jistě hraje roli i preexistující poškození pravé komory, které je demaskováno vyšším preloadem po spuštění LVAD. Při neúspěšné farmakologické léčbě (inotropika, plicní vazodilatátory vč. NO) je řešením implantace dočasné extrakorporální podpory pravé komory, např. Centrimag (Thoratec, USA) [15,16].
Atluri et al identifikovali centrální žilní tlak nad 15 mm Hg, echokardiografické známky těžké dysfunkce pravé komory, předoperační umělou plicní ventilaci, těžkou trikuspidální regurgitaci a srdeční frekvenci nad 100 jako hlavní prediktory pro selhání pravé komory před implantací LVAD s nutností biventrikulární podpory [17].
Beyersdorf et al publikovali výsledky jejich zkušeností při implantaci LVAD jako DT u pacientů s vysokou fixovanou plicní vaskulární rezistencí (PVR) [18]. Významný pokles PVR byl pozorován po několika měsících na podpoře. K redukci PVR došlo i u pacientů s extrémně zvýšenou PVR (nad 7 W.j.) a k obnově plicní hypertenze nedošlo ani po ortotopické transplantaci srdce (OTS). Výsledky přežívání po transplantaci byly u těchto pacientů srovnatelné s výsledky u pacientů bez plicní hypertenze. Obdobné zkušenosti se snížením „fixované“ PVR po unloadingu levé komory při podpoře LVAD byly potvrzeny i autory z jiných pracovišť [18–20].
Gastrointestinální krvácení
Gastrointestinální krvácení je významnou komplikací po implantacích LVAD s kontinuálním průtokem s incidencí 19–40 % [21,22]. Patří k nejčastějším důvodům rehospitalizace během prvních šesti měsíců po implantaci LVAD [23]. Hlavními příčinami jsou arteriovenózní malformace, vysoká antikoagulace a získaný von Willebrandův syndrom. Za příčinu vzniku arteriovenózních malformací je považován samotný kontinuální tok s chronicky nízkým pulzním tlakem, který vede k regionální hypoxii, vaskulární dilataci a následně k angiodysplazii [24].
Fenomén vzniku získaného von Willebrandova syndromu během dlouhodobé podpory LVAD není zatím úplně vysvětlen, tato patologie je však reverzibilní po OTS [25]. Meyer et al nalezli pokles až o 34 % u multimer von Willebrandova faktoru s velkou molekulární hmotností nezávisle na typu přístroje (HeartMate II nebo HeartWare). Tyto molekuly, které patří k největším v lidské plazmě, hrají významnou roli v primární hemostáze a jejich nedostatek vede ke snížené aktivitě a agregaci trombocytů [26].
Infekční komplikace
Postimplantační sepse a infekce přístroje zůstávají rizikem spojeným s implantací LVAD. Achillovou patou dosavadních systémů je perkutánní kabel nutný k přenosu energie z akumulátoru do pumpy. Místo prostupu kabelu přes kůži je nejčastějším místem infekce, ke které dochází až u 20 % pacientů [27]. Nejčastějšími patogeny jsou stafylokoky, enterokoky a pseudomonády, byly popsány i kvasinkové či plísňové infekce. U pacientů se zjištěnou infekcí přístroje je nutno postupovat agresivně s cílenou antibiotickou léčbou, často je nutná i chirurgická intervence.
Cévní mozkové příhody
Dle databáze INTERMACS je riziko cévní mozkové příhody (CMP) jeden měsíc po implantaci LVAD 3 %, po pěti měsících 5 %, po půl roce 7 %, po roce 11 %, po dvou letech 17 % a po třech letech 19 % [28]. Ischemické (tromboembolizační) CMP jsou častější, avšak hemoragické příhody mají horší průběh a vyšší mortalitu. Rizikovými faktory pro ischemickou CMP jsou diabetes mellitus, fibrilace síní, CMP v anamnéze, použití příčné aortální svorky s kardioplegickou zástavou při implantaci LVAD a systémová infekce [29]. Příčinou je embolizace trombů vytvořených v kterékoli části LVAD (vtoková kanyla, pumpa, výtoková protéza) nebo mimo LVAD. Nutná prevence trombózy pumpy antikoagulací a antiagregační terapií v kombinaci s výše popsaným von Willebrandovým syndromem a hypertenzí predisponuje pacienty s LVAD k intrakraniálnímu krvácení. Hemoragické CMP představují jednu z hlavních příčin smrti pacientů s LVAD [30].
Trombóza pumpy a její výměna
Komplikací, která může negativně ovlivnit dlouhodobou správnou funkci LVAD, je trombóza pumpy. Naštěstí jde o komplikaci poměrně vzácnou. Boyle et al analyzovali 469 BTT pacientů s LVAD HeartMate II s incidencí trombózy pumpy pouze 0,9 % u pacientů na warfarinu a protidestičkové léčbě [31]. Bohužel u DT pacientů se trombóza pumpy vzhledem k dlouholeté podpoře již stává významným problémem. Trombóza pumpy nebo podezření na ni bylo nejčastější příčinou výměny pumpy v analýze 1 128 pacientů, z nichž 72 podstoupilo výměnu pumpy v letech 2005– 2010. Operační mortalita výměny pumpy byla po 30 dnech 6,5 % a 65 % pacientů bylo naživu dva roky po výměně [32]. Nejlepší prevencí trombózy pumpy je trvalá striktní kontrola účinné antikoagulace.
Poruchy rytmu
Komorové arytmie jsou u pacientů s LVAD běžné a je popsáno několik případů pacientů přežívajících s komorovou fibrilací na LVAD podpoře [38,39]. Dle současných názorů je implantace LVAD spojena s vytvořením nových arytmogenních jizev v myokardu levé komory [40]. Význam těchto jizev pro rozvoj nových arytmií po implantaci LVAD však zatím jasný není. Cantillon et al uvádí, že přítomnost implantabilního kardioverter defibrilátoru (ICD) zlepšuje přežívání u pacientů s LVAD [41]. V jiné studii bylo zahrnuto 94 pacientů s LVAD, z nichž 77 mělo ICD a 17 nemělo. Celkem 22 pacientů mělo komorové arytmie po více než 30 dnech od implantace LVAD, hlavním prediktorem pooperačních arytmií byla přítomnost komorových arytmií již před implantací LVAD (4,0 vs. 45,5 %; p < 0,001) [42]. Žádný z pacientů propuštěný z nemocnice bez ICD po implantaci LVAD nezemřel během 276 měsíců sledování. Autoři uzavírají studii se závěrem, že pacienti s předoperační anamnézou komorových arytmií mají vysoké riziko rekurentních poruch rytmu po implantaci LVAD a měli by mít aktivní ICD terapii pro minimalizaci rizika. Pacienti bez anamnézy předoperačních komorových arytmií mají nízké riziko a nemusí mít aktivní ICD [6].
Program LVAD v CKTCH Brno
S implantacemi dlouhodobých podpor levé komory srdeční jsme v CKTCH Brno začali v roce 2009. Jednalo se o dnes již klasickou pumpu druhé generace Heartmate II, jejíž implantace vzhledem k její velikosti vyžadovala ještě rozsáhlejší výkon s umístěním vlastní pumpy do preperitoneálního prostoru. Od roku 2013 implantujeme podporu třetí generace Heartware HVAD s výrazně menšími rozměry, které umožňují kompletní intraperikardiální implantaci.
Běžným přístupem pro implantaci LVAD je klasická mediální sternotomie. Miniaturní rozměry pumpy Heartware však umožňují minimálně invazivní implantaci z krátké levostranné torakotomie a ministernotomie. Při zavedení tohoto postupu jsme využili zkušeností kardiochirurgických klinik ve Vídni a v Hannoveru. Minimálně invazivní implantace je v současnosti na našem pracovišti metodou volby. Hlavními argumenty pro tuto chirurgicky náročnější techniku jsou menší krevní ztráty a menší chirurgické trauma. Dále pak méně časté selhání pravé komory vzhledem k tomu, že perikard před pravou komorou není otevřen, a nedojde tak k dilataci pravé komory. Hrudní koš pacienta zůstává víceméně neporušen, což vede k tomu, že doba umělé plicní ventilace po operaci je výrazně kratší. Většina pacientů je extubována první pooperační den, což bylo u klasických implantací spíše výjimečné. Následná transplantace srdce je rovněž jednodušší vzhledem k tomu, že sternum je z větší části intaktní [38].
Celkem jsme v CKTCH Brno naimplantovali od ledna 2009 do září 2016 LVAD jako most k transplantaci srdce u 52 pacientů, z toho 27 miniinvazivně. Transplantaci srdce již podstoupilo 32 pacientů, dalších 11 pacientů je tč. na podpoře. Průměrná doba od implantace LVAD do transplantace je v ncientů, hlavní příčinou smrti bylo ireverzibilní multiorgánové selhání, dále to byla sepse, mozková příhoda a malignita. Celkové jednoleté přežívání po implantaci LVAD je 83 %, což je výsledek plně srovnatelný s předními světovými pracovišti.
Závěr – výhled do budoucnosti
Dlouhodobé LVAD jsou již dnes standardní léčebnou metodou, v ČR využívaná jako most k transplantaci srdce. Počty implantací každoročně narůstají, postupně se zlepšují i klinické výsledky. Nedostatek dárcovských orgánů spolu s narůstajícím výskytem SS povedou v budoucnosti k tomu, že transplantace srdce nebude pro všechny nemocné v terminálním stadiu SS dostupná a implantace LVAD budou představovat léčebnou alternativu.
Nejčastěji používanými typy LVAD jsou celosvětově HeartMate II a Heartware HVAD. Incidence komplikací, jakou jsou trombóza pumpy, infekce přívodného kabelu a CMP, v posledních letech sice stále klesá, i tak však tyto komplikace vedou k významné morbiditě a mortalitě ovlivňující výsledky této terapie. Nové generace těchto přístrojů by měly tyto obtíže postupně řešit.
Další miniaturizace povede k jednodušší a méně traumatické implantaci. Zlepšení povrchů a designu pump by mělo dále snížit riziko trombózy pumpy a vytváření sraženin během dlouhodobé podpory a umožnit méně striktní antikoagulaci. Zásadním krokem k prevenci infekcí bude zavedení bezkabelového transkutánního přenosu energie (transcutaneous energy transfer – TET) [43]. Nové typy pump jako např. HeartMate III by měly imitovat pulzní tok rychlými změnami rychlosti pumpy s potenciálními výhodami oproti pumpám s kontinuálním tokem, jejichž efekt na mikrocirkulaci a orgánovou perfuzi stále není dostatečně pochopen.
Doručeno do redakce: 20. 10. 2016
Přijato po recenzi: 28. 10. 2016
MUDr. Vladimír Horváth
www.cktch.cz
vladimir.horvath@seznam.cz
Zdroje
1. Lund LH, Edwards LB, Kucheryavaya AY et al. International Society for Heart and Lung Transplantation. The Registry of the International Society for Heart and Lung Transplantation: Thirtieth Official Adult Heart Transplant Report 2013; focus theme: age. J Heart Lung Transplant 2013; 32(10): 951– 964. doi: 10.1016/ j.healun.2013.08.006.
2. Englert JA, Davis JA, Krim SR. Mechanical circulatory support for the failing heart: continuous-flow left ventricular assist devices. Ochsner J 2016; 16(3): 263– 269.
3. Goldsmith MF. First implant of portable heart-assist device. JAMA 1991; 265(22): 2930– 2933.
4. Birks EJ, Tansley PD, Hardy J et al. Left ventricular assist device and drug therapy for the reversal of heart failure. N Engl J Med 2006; 355(18): 1873– 1884.
5. Miller LW, Pagani FD, Russell SD et al. HeartMate II Clinical Investigators. Use of a continuous-flow device in patients awaiting heart transplantation. N Engl J Med 2007; 357(9): 885– 896.
6. Rose EA, Gelijns AC, Moskowitz AJ et al. Long-term use of a left ventricular assist device for end stage heart failure. N Engl J Med 2001; 345(20): 1435– 1443.
7. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart silure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016, 18(8): 891– 975. doi: 10.1002/ ejhf.592.
8. Lietz K, Long JW, Kfoury AG et al. Outcomes of left ventricular assist device implantation as destination therapy in the post-REMATCH era: implications for patient selection. Circulation 2007; 116(5): 497– 505.
9. Starling RC, Naka Y, Boyle AJ et al. Results of the post U.S. Food and Drug Administration-approval study with a continuous flow left ventricular assist device as a bridge to heart transplantation: a prospective study using the INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support). J Am Coll Cardiol 2011; 57(19): 1890– 1898. doi: 10.1016/ j.jacc.2010.10.062.
10. Kirklin JK, Naftel DC, Kormos RL et al. Second INTERMACS annual report: more than 1,000 primary left ventricular assist device implants. J Heart Lung Transplant 2010; 29(1): 1– 10. doi: 10.1016/ j.healun.2009.10.009.
11. Holman WL, Pae WE, Teutenberg JJ et al. INTERMACS: interval analysis of registry data. J Am Coll Surg 2009; 208(5): 755– 761, discussion 761– 762. doi: 10.1016/ j.jamcollsurg.2008.11.016.
12. Stevenson LW, Pagani FD, Young JB et al. INTERMACS profiles of advanced heart failure: the current picture. J Heart Lung Transplant 2009; 28(6): 535– 541. doi: 10.1016/ j.healun. 2009.02.015.
13. Estep JD, Trachtenberg BH, Loza LP et al. Continuous flow left ventricular assist devices: shared care goals of monitoring and treating patients. Methodist Debakey Cardiovasc J 2015; 11(1): 33– 44. doi: 10.14797/ mdcj-11-1-33.
14. Slaughter MS, Pagani FD, Rogers JG et al. Clinical management of continuous-flow left ventricular assist devices in advanced heart failure. J Heart Lung Transplant 2010; 29 (4 Suppl): S1– S38. doi: 10.1016/ j.healun.2010.01.011.
15. Aissaoui N, Morshuis M, Schoenbrodt M et al. Temporary right ventricular mechanical circulatory support for the management of right ventricular failure in critically ill patients. J Thorac Cardiovasc Surg 2013; 146(1): 186– 191.
16. Netuka I, Malý J, Szarszoi O et al. Technique of implantation and experience with temporary mechanical cardiac support in right ventricular failure. Rozhl Chir 2011; 90(2): 88– 94.
17. Atluri P, Goldstone AB, Fairman AS et al. Predicting right ventricular failure in the modern, continuous flow left ventricular assist device era. Ann Thorac Surg 2013; 96(3): 857– 863, discussion 863– 864. doi: 10.1016/ j.athoracsur.2013.03.099.
18. Beyersdorf F, Schlensak C, Berchtold-Herz M et al. Regression of “fixed” pulmonary vascular resistance in heart transplant candidates after unloading with ventricular assist devices. J Thorac Cardiovasc Surg 2010; 140(4): 747– 749. doi: 10.1016/ j.jtcvs.2010.05.042.
19. Etz CD, Welp HA, Tjan TD et al. Medically refractory pulmonary hypertension: treatment with nonpulsatile left ventricular assist devices. Ann Thorac Surg 2007; 83(5): 1697– 1705.
20. Zimpfer D, Zrunek P, Roethy W et al. Left ventricular assist devices decrease fixed pulmonary hypertension in cardiac transplant candidates. J Thorac Cardiovasc Surg 2007; 133(3): 689– 695.
21. Morgan JA, Paone G, Nemeh HW et al. Gastrointestinal bleeding with the HeartMate II left ventricular assist device. J Heart Lung Transplant 2012; 31(7): 715– 718. doi: 10.1016/ j.healun.2012.02.015.
22. Stern DR, Kazam J, Edwards P et al. Increas-ed incidence of gastrointestinal bleeding following implantation of the HeartMate II LVAD. J Card Surg 2010; 25(3): 352– 356. doi: 10.1111/ j. 1540-8191.2010.01025.x.
23. Hasin T, Marmor Y, Kremers W et al. Readmissions after implantation of axial flow left ventricular assist device. J Am Coll Cardiol 2013; 61(2): 153– 163. doi: 10.1016/ j.jacc.2012.09.041.
24. Crow S, John R, Boyle A et al. Gastrointestinal bleeding rates in recipients of nonpulsatile and pulsatile left ventricular assist devices. J Thorac Cardiovasc Surg 2009; 137(1): 208– 215. doi: 10.1016/ j.jtcvs.2008.07.032.
25. Geisen U, Heilmann C, Beyersdorf F et al. Non-surgical bleeding in patients with ventricular assist devices could be explained by acquired von Willebrand disease. Eur J Cardiothorac Surg 2008; 33(4): 679– 684. doi: 10.1016/ j.ejcts.2007.12.047.
26. Meyer AL, Malehsa D, Budde U et al. Acquired von Willebrand syndrome in patients with a centrifugal or axial continuous flow left ventricular assist device. JACC Heart Fail 2014; 2(2): 141– 145. doi: 10.1016/ j.jchf.2013.10.008.
27. Goldstein DJ, Naftel D, Holman W et al. Continuous-flow devices and percutaneous site infections: clinical outcomes. J Heart Lung Transplant 2012; 31(11): 1151– 1157. doi: 10.1016/ j.healun.2012.05.004.
28. Kirklin JK, Naftel DC, Kormos RL et al. Fifth INTERMACS annual report: risk factor analysis from more than 6,000 mechanical circulatory support patients. J Heart Lung Transplant 2013; 32(2): 141– 156. doi: 10.1016/ j.healun.2012.12.004.
29. Kato TS, Schulze PC, Yang J et al. Pre-operative and post-operative risk factors associated with neurologic complications in patients with advanced heart failure supported by a left ventricular assist device. J Heart Lung Transplant 2012; 31(1): 1– 8. doi: 10.1016/ j.healun.2011.08.014.
30. Pagani FD, Miller LW, Russell SD et al. HeartMate II Investigators. Extended mechanical circulatory support with a continuous-flow rotary left ventricular assist device. J Am Coll Cardiol 2009; 54(4): 312– 321. doi: 10.1016/ j.jacc.2009.03.055.
31. Menon AK, Götzenich A, Sassmannshausen H et al. Low stroke rate and few thrombo-embolic events after HeartMate II implantation under mild anticoagulation. Eur J Cardiothorac Surg 2012; 42(2): 319– 323, discussion 323. doi: 10.1093/ ejcts/ ezr312.
32. Moazami N, Milano CA, John R et al. Pump replacement for left ventricular assist device failure can be done safely and is associated with low mortality. Ann Thorac Surg 2013; 95(2): 500– 505. doi: 10.1016/ j.athoracsur.2012.09.011.
33. Nishimura M, Ogiwara M, Ishikawa M. Fifteen-month circulatory support for sustained ventricularfibrillation by left ventricular assist device. J Thorac Cardiovasc Surg 2003; 126(4): 1190– 1192.
33. Oz MC, Rose EA, Slater J et al. Malignant ventricular arrhythmias are well tolerated in patients receiving long-term left ventricular assist devices. J Am Coll Cardiol 1994; 24(7): 1688– 1691.
34. Ziv O, Dizon J, Thosani A et al. Effects of left ventricular assist device therapy on ventricular arrhythmias J Am Coll Cardiol 2005; 45(9): 1428– 1434.
35. Cantillon DJ, Saliba WI, Wazni OM et al. Low cardiac output associated with ventricular tachyarrhythmias in continuous-flow LVAD recipients with a concomitant ICD (LoCo VT Study). J Heart Lung Transplant 2014; 33(3): 318– 320. doi: 10.1016/ j.healun.2013.11.005.
36. Garan AR, Yuzefpolskaya M, Colombo PC et al. Ventricular arrhythmias and implantable cardioverter-defibrillator therapy in patients with continuous-flow left ventricular assist devices: need for primary prevention? J Am Coll Cardiol 2013; 61(25): 2542– 2450. doi: 10.1016/ j.jacc.2013.04.020.
37. John R, Naka Y, Smedira NG et al. Continuous flow left ventricular assist device outcomes in commercial use compared with the prior clinical trial. Ann Thorac Surg 2011; 92(4): 1406– 1413, discussion 1413. doi: 10.1016/ j.athoracsur.2011.05.080.
38. Horvath V, Ondrasek J, Fila P et al. Minimally invasive implantation of left ventricular assist device HeartWare HVAD. Cor Vasa 2015; 57(2): e70– e74.
39. Puehler T, Ensminger S, Schoenbrodt M et al. Mechanical circulatory support devices as destination therapy – current evidence. Ann Cardiothorac Surg 2014; 3(5): 513– 524. doi: 10.3978/ j.issn.2225-319X.2014.08.20.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2016 Číslo 4
Nejčtenější v tomto čísle
- Dlouhodobé levokomorové srdeční podpory v léčbě srdečního selhání
-
Komentář k Doporučeným postupům ESC/ ČKS
Diagnostika srdečního selhání - Léčba hypertenze starších nemocných
- Lipertance® – dva problémy, jedno řešení
