Rehabilitace po infarktu myokardu (III)
Rehabilitation after myocardial infarction (III)
The authors devote the third part of patients’ rehabilitation
after myocardial infarction to some general aspects related to this problems. They address both
safety of rehabilitation programs and patients’ inclusion aspects. They pay special attention to the
impact of training on patients’ prognosis and to the cardioprotective effect of physical exercise. They
conclude with rules for practical training of patients with coronary heart disease.
Keywords
myocardial infarction – program of rehabilitation – cardioprotective effect of physical exercise – coronary heart disease
Autoři:
doc. MUDr. Václav Chaloupka, CSc.; doc. MUDr. Lubomír Elbl, CSc.
Působiště autorů:
FN Brno-Bohunice
; oddělení funkčního vyšetřování
Vyšlo v časopise:
Kardiol Rev Int Med 2005, 7(4): 187-190
Kategorie:
Redakční článek
Souhrn
Ve 3.
části Rehabilitace u nemocných po infarktu myokardu se autoři věnují některým obecným otázkám spojeným s touto problematikou. Zabývají se bezpečností rehabilitačních programů, ale i problematikou zařazení nemocných. Podrobněji si všímají vlivu tréninku na prognózu nemocných a kardioprotektivního účinku fyzické zátěže. Závěrem pak vytyčují zásady racionálního tréninku u nemocných s ischemickou chorobou srdeční.
Klíčová slova
infarkt myokardu – rehabilitační program – kardioprotektivní účinek fyzické zátěže – ischemická choroba srdeční
V našich předchozích sděleních o rehabilitaciu infarktu myokardu jsme se zaměřili na některé specifické otázky rehabilitace, a také na rehabilitaci u starších nemocných a nemocných se srdečním selháním [1,2]. V této části bychom se rádi zmínili o některých všeobecných a praktických aspektech rehabilitaceu nemocných po infarktu myokardu (IM).
Bezpečnost rehabilitačních programů
Relativní bezpečnost rehabilitačních programů byla opakovaně prokázána. Výskyt kardiovaskulárních komplikací během řízené rehabilitaceu současně vedených programů se udávána 1/50 000 až 1/120 000 pacient/hodin s pouze 2 fatálními příhodami na 1,5 milion pacient/hodin cvičení [3]. Riziková stratifikace umožňuje identifikaci nemocných s vyšším rizikem a jejich intenzivnější sledování. Za 12 let, kdy na našem pracovišti provádíme rehabilitaci nemocných po infarktu myokardu, jsme se v průběhu cvičební jednotky s fatální příhodou nesetkali. 1krát jsme prováděli úspěšnou resuscitaci pro fibrilaci komor, která vznikla při cvičení na veslech. 1 nemocný s recidivujícím IM zemřel doma v době, kdy byl zařazen do programu na našem pracovišti. U 1 nemocného došlo k drobné recidivě IM bezprostředně po ukončení cvičební jednotky. Nemocný měl potíže již v noci, ale na cílený dotaz odpověděl negativně.
Zařazení nemocných do rehabilitačního programu
Důležitým aspektem je doba, kdy můžeme s časným tréninkem v rámci fáze II po propuštění z nemocnice začít. Zahájení rehabilitace by mělo následovat co nejdříve, pokud možno do 3 týdnů po propuštění. Průměrná doba zařazení pacienta do rehabilitačního programu od vzniku akutního IM je na našem pracovišti 31 ± 7 dní (medián 29 dní, 13–44) u nemocných léčených PTCA. U pacientů, kteří se podrobili kardiochirurgickému zákroku, byla doba delší, 45 ± 19 dní (medián 33 dní, 23–68) [4].
V tomto směru nemusí být naše výsledky plně srovnatelné se zahraničními, kde citované práce mají často charakter pilotních studií. V našem případě se stal ambulantní řízený rehabilitační program standardním přístupem v léčbě a sekundární prevenci ICHS u nemocných po akutním IM léčeném v naší nemocnici. Medián doby od vzniku akutního IM po zařazení do rehabilitace se nachází na dolní hranici ve srovnání s jinými pracovišti, kde se pohybuje mnohdy z „bezpečnostních“ důvodů od 4–6 týdnů až po několik měsíců po akutní koronární příhodě. Tento fakt ovlivňuje i skutečnost, že v mnoha případech pacienti nerehabilitují v centrech pod odborným vedením, ale v domácím prostředí. I tak považujeme medián doby zařazení do rehabilitace za poměrně dlouhý, ale odráží jen naše kapacitní možnosti a dobu potřebnou na provedení vstupních testů. Výjimku tvoří nemocní po kardiochirurgickém zákroku, které posuzujeme individuálně s ohledem na proces hojení po sternotomii a přítomnost dalších pooperačních komplikací. Některá lázeňská pracoviště zavádějí rehabilitační program „z lůžka na lůžko“. Zda a u kterých nemocných se tento přístup osvědčí, ukáží až další výsledky v budoucnosti.
Vliv na zátěžovou kapacitu
Fyzický trénink a pravidelné denní aktivity (např. chůze, jízda na kole a jiné sportovní činnosti) jsou zásadní pro tělesnou zdatnost (fitness). Tělesná zdatnost, která je cílem fyzické aktivity, je definovaná jako „schopnost vykonávat střední až intenzivní stupeň fyzické aktivity bez přílišné únavy a udržet ji v průběhu života“. Fyzická zdatnost může být dosažena a udržována u nemocných v každém věku a fyzické kondici.
Řízené rehabilitační programy vykazují zlepšení spotřeby kyslíku o 11 až 36 %, s optimálním zlepšením u nemocných s nejhorší kondicí [5]. Větší kondice zlepší u nemocných kvalitu života a snižují závislost starších nemocných na cizí pomoci.
Pozitivní změna kondice snižuje submaximální tepovou frekvenci, systolický krevní tlak a také dvojprodukt, a tím vede ke snížení myokardiální spotřeby kyslíku během aktivit každodenního života. U nemocných s pokročilou ischemickou chorobou srdeční (ICHS) se zvyšuje ischemický práh, a umožňuje tak nemocným vykonávat intenzivnější činnost bez projevů např. anginy pectoris nebo projevů ischemie na elektrokardiogramu. Na tomto efektu se podílí jak vytrvalostní zátěž, tak i zlepšení svalové síly pomocí silového tréninku. Zlepšená tolerance zátěže je také spojena s významnou redukcí fatálních i nefatálních kardiovaskulárních příhod [6,7,8]. Tyto výsledky se týkají i nemocných se srdečním selháním. V nedávno publikované metaanalýze 81 studií zahrnující 2 587 nemocných se stabilním srdečním selháním autoři ukázali trend k delšímu přežívání (p = 0,06) spojenému se zlepšenou funkční kapacitou, a také snížení kardiorespiračních příznaků po aerobním a silovém tréninku [9].
Vliv na kardiovaskulární prognózu
Během posledních 50 let ukázala řada studií snížený výskyt první kardiovaskulární příhody u fyzicky aktivních osob [10,11]. Tyto nálezy, společně se studiemi, které poukazují na možný kardioprotektivní efekt, poskytují dostatečné důkazy, že pravidelná fyzická aktivita alespoň střední intenzity snižuje riziko koronárních příhod. Současně vedou k závěru, že fyzická inaktivita patří mezi hlavní rizikové faktory ICHS. Vliv na aerobní kapacitu je větší, je-li vytrvalostní trénink dostatečně intenzivní a pravidelný. Výsledky z Health Profesionals’ Follow-up Study ukázaly, že dokonce pouze 30 minut silového tréninku týdně může významně snížit riziko iniciální koronární příhody [12].
K posouzení efektu fyzického tréninku na morbiditu a mortalitu se vzhledem k absenci randomizovaných studií prováděly metaanalýzy menších studií. Metaanalýzy založené na studiích ze 70. a 80. let a publikované v roce 1994 v přehledu American Heart Association ukázaly statisticky významné snížení jak kardiální, tak celkové mortality po dokončení rehabilitačních programů zahrnujících fyzický trénink [13,14]. Nebyl však statisticky významný pokles nefatálních kardiovaskulárních příhod. Nemocní zařazovaní do těchto programů byli především muži středního věku po infarktu myokardu s nízkým rizikem. Ženy, starší nemocní a nemocní po revaskularizačních zákrocích nebo s jiným srdečním postižením většinou nebyli zařazeni.
Velký pokrok v léčbě ICHS v 90. letech nastolil otázky o významu těchto závěrů o nezávislém efektu cvičení na kardiovaskulární mortalitu a morbiditu. Pokrok v léčbě zahrnuje především stále častější koronární intervence a následkem toho zmenšení reziduálního postižení myokardu následkem koronární okluze.
Řada studií jasně ukázala, že široké profylaktické použití statinů významně snižuje kardiovaskulární mortalitu i morbiditu [15–18]. Všechny tyto studie prokázaly jednoznačný a těžko zpochybnitelný prospěch u všech skupin intervenovaných nemocných jak v primární, tak sekundární prevenci. Z observačních studií je známo, že je víceméně lineární vztah mezi hodnotou cholesterolu a kardiovaskulární úmrtností a tento vztah funguje minimálně k hodnotám celkového cholesterolu 3,5 mmol/l. V rámci sekundární prevence představuje léčba statiny společně s betablokátory, kyselinou acetylsalicylovou a ACE-inhibitory standardní léčbu ischemické choroby srdeční.
Biotechnické pokroky, které zlepšují přežití nemocných, představují konvenční nebo lékové stenty, implantabilní kardiovertery defibrilátory a biventrikulární stimulace. Ve světle tohoto pokroku je další nebo dodatečný efekt kondičního tréninku na morbiditu a mortalitu nemocných nejasný.
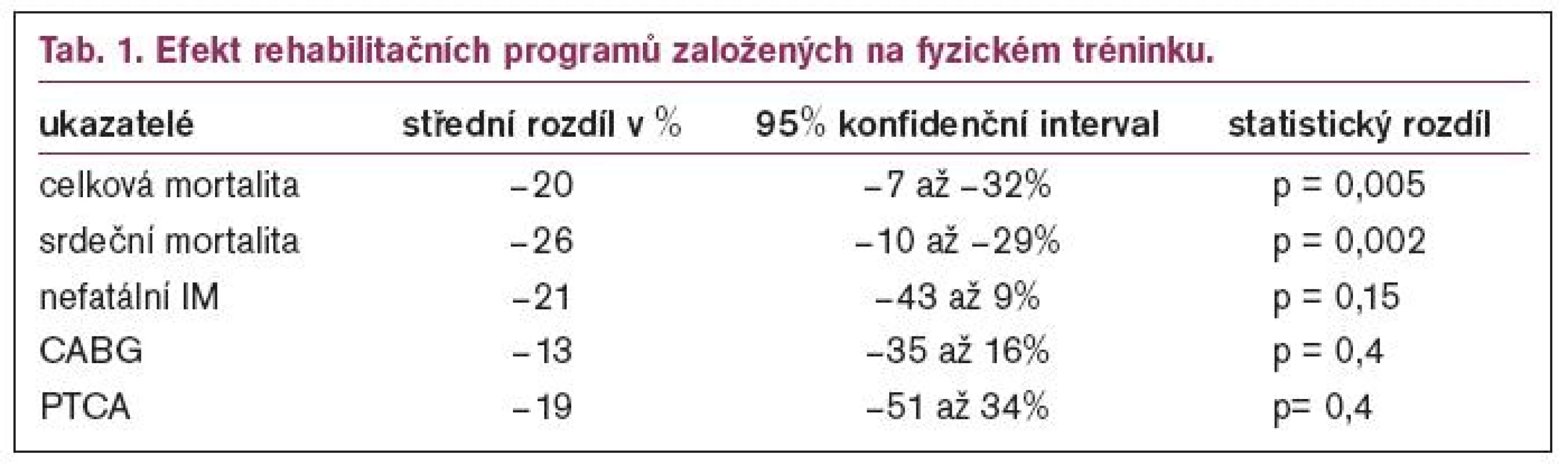
Taylor et al publikovali povzbudivá data v metaanalýze založené na 48 randomizovaných studiích trvajících ≤ 6 měsíců, ve které srovnávali výsledky u nemocných, kteří absolvovali rehabilitační program (exercise based rehabilitation) s nemocnými léčenými standardně. Tato metaanalýza aktualizuje dřívější studii a přidává více než 4 000 nemocných s ICHS na celkový počet 8 940 nemocných. V daleko větší míře než dříve jsou zahrnuty ženy (20 %), starší nemocní (≥ 65 let) a také nemocní po revaskularizačním zákroku. Jak ukazuje tab. 1, u nemocných, kteří absolvovali rehabilitační program, byla statisticky významně nižší celková i kardiovaskulární mortalita, což bylo v souhlase s předchozími referencemi. Nebyl rozdíl mezi studiemi provedenými před rokem 1995 nebo po něm. Příznivý trend byl rovněž pozorován ve výskytu nefatálního infarktu myokardu a počtu revaskularizací, ale tento trend nedosáhl statistické významnosti. V omezeném počtu studií zařazených do této metaanalýzy byly příznivější výsledky týkající se ovlivnitelných rizikových faktorů u fyzicky aktivních nemocných. Kvalita života byla hodnocena různými ukazateli pouze asi u 25 % klinických studií a podobné zlepšení bylo pozorováno jak u rehabilitujících nemocných, tak v kontrolní skupině.
Kardioprotektivní účinky fyzického tréninku
Je známo, že fyzický trénink jako součást komplexních rehabilitačních programů může zpomalit progresi nebo částečně redukovat tíži koronární aterosklerózy [19,20]. Řada faktorů, ať již přímo nebo nepřímo, přispívá k tomuto antisklerotickému efektu. Cvičení zlepšuje endoteliální funkci spojenou se zvýšenou syntézou, uvolňováním a délkou účinku oxidu dusného [21]. Oxid dusný reguluje na endotelu závislou vazodilataci a inhibuje řadu faktorů vedoucích k aterogenezi a trombóze. Hambecht et al ukázali významné zlepšení na endotelu závislé tepenné dilatace u nemocných s ICHS a abnormální endoteliální funkci po 4 týdnech intenzivního vytrvalostního tréninku [22].
Chronický zánět hraje významnou roli v patogenezi ICHS a ovlivňuje stabilitu atrosklerotických plátů. Vyšší plazmatická hladina C-reaktivního proteinu je spojena s vyšším rizikem ICHS. Aerobní trénink a zlepšená tolerance zátěže vede k nižším hodnotám C-reaktivního proteinu, což svědčí pro protizánětlivý efekt fyzického tréninku [23].
Fyzický trénink se samozřejmě uplatňuje i při modifikaci další rizikových faktorů. Vytrvalostní trénink má příznivý vliv na úpravu krevního tlaku, pokles triglyceridů a vzestup HDL-cholesterolu. Zvyšuje senzitivitu k inzulinu a upravuje glukózový metabolizmus, což s redukcí váhy snižuje riziko vzniku diabetes mellitus 2. typu. Aerobní trénink tak může příznivě ovlivnit všechny komponenty metabolického syndromu a působit jako léčba první volby. Mimo ovlivnění glukózového metabolizmu se samozřejmě uplatňuje i efekt na diastolickou funkci levé komory, endoteliální dysfunkci nebo zánětlivé změny [24].
Vytrvalostní trénink má rovněž potenciální antiischemický efekt. Jako už bylo zmíněno, fyzický trénink snižuje myokardiální spotřebu kyslíku snížením dvojproduktu, a tím zvyšuje ischemický práh. Trénink také zvyšuje průtok krve koronárními tepnami zlepšením poddajnosti nebo elasticity tepen. Uplatňuje se také na endotelu závislá vazodilatace a zvětšení plochy lumina tepny remodelací a novotvorba myokardiálních kapilár [25].
Někteří autoři také poukazují na skutečnost, že fyzická aktivita navozuje ischemický preconditioning myokardu, proces, při kterém přechodné ischemie během zátěže zvyšují toleranci myokardu k následnému prolongovanému ischemickému stresu, a tím se snižuje poškození myokardu a riziko potenciálních letálních tachyarytmií. Fyzický trénink může také snížit riziko náhlé smrti snížením sympatické a zvýšením vagové aktivity, což dokladuje zvýšení variability srdečního rytmu a zvýšení baroreceptorové senzitivity [26,27].
Při fyzickém tréninku se uplatňují i příznivé hemostatické účinky, které mohou snížit riziko trombotické okluze v koronární tepně po disrupci vulnerabilního plátu. Antitrombotický efekt zahrnuje zvýšený plazmatický objem, sníženou viskozitu krve, sníženou agregaci destiček a zvýšenou trombolytickou aktivitu. Některé studie ukázaly, že fyzický trénink může snížit plazmatickou hladinu fibrinogenu [28].
Kontraindikace fyzického tréninku
Je třeba zvážit absolutní a relativní kontraindikace fyzického tréninku. Za absolutní se obecně pokládají: nestabilní angina pectoris, manifestní srdeční selhání, dissekující aneuryzma aorty, komorová tachykardie nebo jiné život ohrožující arytmie, klidová sinusová tachykardie > 120/min, těžká aortální stenóza, žilní trombóza a podezření na plicní embolii, akutní infekční onemocnění, systolický TK > 200 mm Hg a diastolický tlak > 115 mm Hg a symptomatická hypotenze [29].
Struktura rehabilitačních programů
Rehabilitace může probíhat jako řízený ambulantní trénink, individuální trénink nebo lázeňská léčba [29]. Za optimální pokládáme zařazení nemocného do řízeného ambulantního tréninku.
Většina rehabilitačních programů je organizována 3krát týdně po dobu 2–3 měsíců. Samozřejmě se předpokládá určitá pohybová aktivita i v ostatních dnech. Cvičební jednotka se skládá z fáze zahřívací, vlastního aerobního cvičení a na závěr z relaxační části. Celková doba cvičební jednotky je asi 60–90 minut. Před jejím zahájením je třeba zjistit hodnoty TK a TF a zeptat se nemocného na subjektivní potíže (stenokardie, dušnost). Hodnoty TK a pulzu je třeba sledovat i v průběhu aerobní zátěže a bezprostředně po ní, u osob s vyšším rizikem nebo arytmiemi je vhodné v průběhu cvičení nemocného monitorovat.
Individuální domácí trénink se týká většiny nemocných po propuštění, a proto by na něj měl být kladen patřičný důraz. Vedle nezbytných informací, které by měl nemocný získat již během hospitalizace, je nutné poučení o vhodném způsobu a intenzitě cvičení. V počátečním období je nejvhodnější aktivitou chůze. Orientační hodnoty jsou uvedeny v tab. 2. Individuální trénink by měl řídit ošetřující kardiolog.
Ústavní lázeňská rehabilitační léčba slouží k upevnění vytvořených návyků správného životního stylu, k eliminaci existujících rizikových faktorů ischemické choroby srdeční a potlačení stresových psychických vlivů. Odeslání pacientů k ústavní rehabilitační léčbě se řídí indikačním seznamem. U některých nemocných je možný překlad z kardiologického pracoviště přímo k lázeňské léčbě.
Základní principy racionálního tréninku u nemocných s ischemickou chorobou srdeční
Bezpečnost. K posouzení odpovědi nemocného na zátěž je optimální zahájit trénink jako řízený nemocniční program. Klinická reakce upozorní na nutnost modifikovat nebo přerušit trénink a postupně nastavit vhodnou zátěž pro individuální trénink nebo změnit terapii.
Pravidelnost. Zlepšení tolerance zátěže lze získat pouze pravidelnou fyzickou aktivitou, alespoň 3–5krát týdně. Zlepšení aerobní kapacity a symptomů se objevuje během 4 týdnů s maximem v 16–26 týdnu. Vysazení pravidelného cvičení však vede rychle ke ztrátě získaného efektu.
Aerobní trénink. Pravděpodobně nejvhodnějším způsobem je trénink na rotopedu. Umožňuje přesně dávkovat a kontrolovat zátěž, ale i oběhové a klinické ukazatele (TK, tepová frekvence). Umožňuje také použít intervalový trénink, což je střídání krátkých úseků zátěže (50–80 % peak VO2) se zotavením minimální zátěží (10 W) např. v poměru 15–30s/60s. Ukazuje se, že intervalový trénink představuje intenzivnější impulz pro periferní změny a je zvláště vhodný pro nemocné limitované symptomy u chronického srdečního selhání (CHSS) [30].
Zahřívací a relaxační část. Nejlepší v prevenci kardiovaskulárního, ale i muskuloskeletárního poškození při vlastním aerobním cvičení je počáteční zahřátí (warm-up) 5–10min zátěží menší intenzity a na závěr relaxační cvičení (cool-down), které je stejně důležité jako fáze zahřívací, především v prevenci arytmií a hypotenze.
Silový trénink. Je vhodné zařazovat i prvky silového tréninku, jako prevenci svalové atrofie, která se při nečinnosti velmi rychle rozvíjí. V posledních letech se objevily práce, poukazující na prospěšnost zařazování silového cvičení jako doplněk klasického aerobního tréninku i u nemocných s CHSS. Zařazování silových cvičení je vhodné alespoň 2krát týdně. Podrobně jsme tuto problematiku probrali v našem předchozím sdělení [2].
Intenzita zátěže. Intenzita aerobní aktivity je energie potřebná k vykonání této aktivity ve vztahu k maximální aerobní kapacitě, tj. maximální spotřebě kyslíku (VO2max). Je to taková spotřeba kyslíku, která při dalším zvyšování zátěže již neroste. V praxi se však s touto hodnotou nesetkáváme, protože nemocný končí před dosažením plateau spotřeby O2. Z tohoto důvodu je vhodnější použití termínu vrcholová spotřeba kyslíku (peak VO2).
Posouzení intenzity zátěže lze jednak podle procent peak VO2, procent maximální tepové frekvence a podle subjektivního vnímání námahy. Užívané hodnoty intenzity zátěže podle spotřeby kyslíku se udávají v širokém rozmezí 40–80 % peak VO2. U nemocných s nižší tolerancí zátěže může být dosaženo tréninkového efektu vyšší frekvencí a trváním zátěže. Hodnocení podle tepové frekvence je založeno na lineárním vztahu mezi TF, spotřebou kyslíku a zátěží, ale většinou má pouze orientační význam. Přesto by měl cvičenec znát svoji tepovou frekvenci a naučit se ji měřit. Sám pak pozná, že po určité době zvládne stejnou zátěž s nižší tepovou frekvencí a může přidat na intenzitě. Vhodnou intenzitu je možno hodnotit i podle klasifikace vnímané únavy dle Borga [31]. U nemocných s CHSS je vhodná zátěž odpovídající vnímané námaze < 13. Zlepšení aerobní kapacity i u nemocných s nízkou nebo střední intenzitou tréninku svědčí pro to, že pokles v intenzitě lze z části nebo plně kompenzovat prodloužením nebo vyšší frekvencí tréninku.
Trvání a frekvence zátěže. Trvání a frekvence zátěže záleží na výchozím funkčním stavu nemocného. U nemocných s funkční kapacitou < 3 METs (25–40 W) se doporučuje několikrát denně krátké cvičení v trvání 5–10 min, pro nemocné s funkční kapacitou 3–5 METs (40–80 W) 1–2× denně 15 minut. U nemocných s funkční kapacitou > 5 METs 3–5× týdně 20–30 minut cvičení. Obecně platí, že při zlepšování funkční kapacity zvyšujeme zátěž trváním, frekvencí a naposledy intenzitou.
Závěr
Fyzická inaktivita je samozřejmě pouze jedním z rizikových faktorů, který je potřeba v léčbě nemocných po IM odstranit. Proto jsou rehabilitační programy založené na fyzickém tréninku součástí komplexní sekundární prevence. I když víme, že pravidelný cílený trénink příznivě ovlivňuje řadu rizikových faktorů a může snížit nezbytnou farmakoterapii, je pro mnohé nemocné bohužel daleko přijatelnější brát mnoho léků, než pravidelně trénovat. Navíc moderní revaskularizační léčba s krátkou hospitalizací vzbuzuje u mnohým nemocných mylnou představu o nezávažnosti onemocnění a jednoduchosti léčby, a nutnost využít všech možností sekundární prevence, včetně fyzického tréninku, podceňují.
Zdroje
1. Chaloupka V, Elbl L. Rehabilitace po infarktu myokardu. Kardiol Rev 2005; 7(1): 5–9.
2. Chaloupka V, Elbl L. Rehabilitace po infarktu myokardu II. Kardiol Rev 2005; 7(2): 73–76.
3. Franklin BA, Bonzheim K, Gordon S, Timmis GC. Safety of medically supervised cardiac rehabilitation exercise therapy: a 16-year follow-up. Chest 1998; 114 : 902–906.
4. Elbl L, Chaloupka V, Tomášková I et al. Silový trénink u nemocných po akutním infarktu myokardu se sníženou ejekční frakcí levé komory srdeční. Vnitř Lék 2005; 51(1): 41–47.
5. Ades PA. Cardiac rehabilitation and secondary prevention of coronary heart disease. N Eng J Med 2001; 345 : 892–902.
6. Mark DB, Lauer MS. Exercise capacity: the prognostic variable that doesn't get enough respect. Circulation 2003; 108 : 1534–1536.
7. Myers J, Prakash M, Froelicher V et al. Exercise capacity and mortality of men referred for exercise testing. N Engl J Med 2002; 346 : 793–801.
8. Kavanagh T, Mertens DJ, Ham LF et al. Prediction of long-term prognosis in 12 169 men referred for cardiac rehabilitation. Circulation 2002; 106 : 666–671.
9. Smart N, Marwick TH. Exercise training for patients with heart failure: a systematic review of factors that improve mortality and morbidity. Am J Med 2004; 116(10): 693–706.
10. Shephard RJ, Balady GJ. Exercise as cardiovascular therapy. Circulation 1999; 99 : 963–972.
11. Lakka TA, Venalainen JM, Rauramaa R et al. Relation of leisure-time physical activity and cardiorespiratory fitness to the risk of acute myocardial infarction.
N Engl J Med 1994; 330 : 1549–1554.
12. Tanasescu M, Leitzmann MF, Rimm EB et al. Exercise type and intensity in relation to coronary heart disease in men. JAMA 2002; 288 : 1994–2000.
13. O’Connor GT, Buring JE, Yusuf S et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation 1989; 80 : 234–244.
14. Oldrige NB, Guyatt GH, Fisher ME, Rimm AA. Cardiac rehabilitation after myocardial infarction: combined experience of randomized clinical trials. JAMA 1988; 260 : 945–950.
15. The Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344 : 1383–1389.
16. Sacks FM, Pfeffer MA, Moye L et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996; 335 : 1001–1009.
17. Shepherd J, Cobbe SM, Ford I et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med 1995; 333 : 1301–1307.
18. The Long-term Intervention with Pravastatin in Ischemic Disease (LIPID) Study group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998; 339 : 1349–1357.
19. Niebauer J, Hambrecht R, Velich T et al. Attenuated progression of coronary artery disease after 6 years of multifactorial risk intervention: role of physical exercise. Circulation 1997; 96 : 2534–2541.
20. Haskell WL, Alderman EL, Fair JM et al. Effects of intensive multiple risk factor reduction on coronary atherosclerosis and clinical cardiac events in men and women with coronary artery disease. The Stanford Coronary Intervention Prevention Project (SCRIPT). Circulation 1994; 89 : 975–990.
21. Dimmeler S, Zeiher AM. Exercise and cardiovascular health: get active to “AKTivate” your endothelial nitric oxid synthase. Circulation 2003; 107 : 3118–3120.
22. Hambrecht R, Wolf A, Gielen S et al. Effect of exercise on coronary endothelial function in patients with coronary artery disease. N Eng J Med 2000; 342 : 454–460.
23. LaMonde MJ, Durstine JL, Yanowitz FG et al. Cardiorespiratory fitness and C reactive protein among tri-ethnic sample of women. Circulation 2002; 106 : 403–406.
24. Grundy SM, Hansen B, Smith SC et al. Clinical management of metabolic syndrome: report of the American Heart Association/National Heart, Lung, and Blood Institute/American Diabetes Association conference on scientific issue related to management. Circulation 2004; 109 : 551–556.
25. Laughlin MH, Oltman C, Bowles DK. Exercise training – induced adaptation in the coronary circulation. Med Sci Sport Exerc 1998; 30 : 352–360.
26. Bolli R. The late phase of preconditioning. Circ Res 2000; 87 : 972–983.
27. Iellamo F, Legramante JM, Massaro MA et al. Effects of residential exercise training on baroreflex sensitivity and heart rate variability in patients with coronary artery disease: a randomised, controlled study. Circulation 2000; 102 : 258–2592.
28. Rauramaa R, Li G, Vaisanen SB. Dose-response and coagulation and hemostatic factors. Med Sci Sports Exerc 2001; 33: S516–S520.
29. Chaloupka, V, Vaněk P, Juráň F et al. Nemocniční, posthospitalizační a lázeňská rehabilitace u nemocných s ICHS. Cor Vasa 1998; 40: K243–K251.
30. Mayer K, Samek L, Schwaibold M et al. Interval training in patients with severe chronic heart failure: analysis and recommendation procedures. Med Sci Sports Exerc 1997; 29 : 306–312.
31. Borg GAV. Psychophysical bases of perceived exertion. Med Sci Sports Exerc 1982; 14 : 377–381.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2005 Číslo 4
Nejčtenější v tomto čísle
- Akutní infarkt myokardu při okluzi kmene levé věnčité tepny: zkušenosti z počátku 3. tisíciletí
- Plicní hypertenze a cor pulmonale
- Losartan v klinických studiích
- Rehabilitace po infarktu myokardu (III)