Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
The most important diagnostic procedures in acute stroke
Stroke is the second leading cause of death and the leading cause of permanent disablement in elderly population worldwide. About 80% of all stroke cases are ischemic due to thrombotic or embolic artery occlusion. The rest of them are caused by hemorrhage. The rapid and precise diagnostic workup is crucial for the most effective treatment choice. The new possibilities of treatment (especially in ischemic stroke) lead to the need of quantitativly and qualitativly better data acquirement mostly from neuroimaging. The detailed knowledge of stroke imaging possibilities is recently necessary for stroke practitioners. This article describes mostly the diagnostic procedures in acute ischemic stroke and intracerebral hemorrage because those are the dominant issue in neurologic stroke care.
Keywords:
stroke – CT – MRI – ultrasound
Autoři:
MUDr. Michal Reif; MUDr. David Goldemund; doc. MUDr. Robert Mikulík, Ph.D.
Působiště autorů:
Mezinárodní centrum klinického výzkumu (ICRC) a Neurologická klinika FN u sv. Anny v Brně
michal. reif@fnusa. cz
Vyšlo v časopise:
Kardiol Rev Int Med 2013, 15(1): 11-25
Kategorie:
Cévní mozkové příhody
Souhrn
Cévní mozkové příhody jsou celosvětově druhou nejčastější příčinou úmrtí a nejčastější příčinou invalidity u starších nemocných. Asi 80 % všech cévních mozkových příhod tvoří mozkové infarkty a většina z nich vzniká uzávěrem mozkové tepny na podkladě trombózy či embolizace. Zbylých 20 % představují krvácivé cévní mozkové příhody. Přesná a rychlá diagnostika je zásadní pro volbu správného a co nejefektivnějšího terapeutického postupu. Rozšiřování léčebných možností, obzvláště v oblasti ischemické cévní mozkové příhody, vede ke zvyšování nároků na kvalitu a množství informací zejména z neurozobrazovacích vyšetření. Poměrně detailní znalost problematiky cévních mozkových příhod zobrazení se stává pro lékaře řešícího akutní cévní mozkové příhody nutností. Článek se věnuje především diagnostickým postupům u akutního mozkového infarktu a intracerebrálního hematomu, které jsou doménou v neurologické péči o cévní mozkové příhody.
Klíčová slova:
CMP – CT – MRI – ultrazvuk
Úvod
Původní rolí diagnostického procesu v případě podezření na akutní cévní mozkovou příhodu (CMP) bylo tuto diagnózu potvrdit (resp. vyloučit jinou etiologii obtíží) a určit, o který typ CMP se jedná. V současné době se díky novým technikám neurozobrazení hledají algoritmy, které umožní určit nejvýhodnější terapeutický postup ve smyslu minimalizace rizika a maximalizace prospěchu. Vedle zhodnocení klinických dat (příznaky a relevantní anamnestické údaje), které významně přispívají k určení směru vyšetřovacího algoritmu, jsou nejdůležitějším prvkem tohoto „diagnostického puzzle“ právě zobrazovací metody. Využití tzv. multimodalitního vyšetřovacího schématu umožňuje nejen jednoznačně odlišit ischemickou a hemoragickou CMP, event. onemocnění, které příznaky CMP imitují, ale také získat důležité údaje o rozsahu postižené mozkové tkáně, o její aktuální vitalitě a o stavu tepenného řečiště. Všechna tato data přispívají k volbě nejvhodnějšího terapeutického postupu, odhadu prognózy, monitoraci úspěšnosti léčby či změn zvyšujících riziko komplikací. V současnosti není kvalitní péče o akutní CMP bez těchto vyšetření možná. Nutnost rychlého jednání je zásadní a diagnostické neurozobrazení by mělo být provedeno nejpozději do 30 min od příjezdu do nemocnice [1].
Hrubé diagnostické schéma lze přibližně zobrazit následně (diagram 1). Využití jednotlivých vyšetření (vč. modalit) a jejich kombinace závisí na diagnostických a terapeutických možnostech pracoviště a rovněž na konkrétních klinických datech (čas vzniku, klinické symptomy – tíže, dynamika apod.).

Neurologické vyšetření a anamnestická data
Klasické neurologické vyšetření je nedílnou a důležitou součástí diagnostického postupu u akutní CMP. Jeho součástí je i získání relevantních anamnestických dat jak z hlediska předchorobí (údaje o cévních rizikových faktorech, prodělaných CMP, kardiálních onemocněních aj.), tak okolností vzniku příznaků (rychlost, charakter a zejména čas jejich rozvoje). Informace pomáhají nasměrovat vyšetřovací algoritmus, určit nejpravděpodobnější lokalizaci léze a tím také přispět k specifičtějšímu zaměření dalších vyšetřovacích metod.
Důležité je však zdůraznit, že samotné klinické vyšetření není dostatečně citlivé k zjištění etiologie příznaků CMP (tzv. stroke-like symptomy) a tedy ani k odlišení hemoragické a ischemické CMP. Některé indicie mohou zvyšovat pravděpodobnost jedné z variant, ale k definitivnímu stanovení je vždy nutné neurozobrazovací vyšetření.
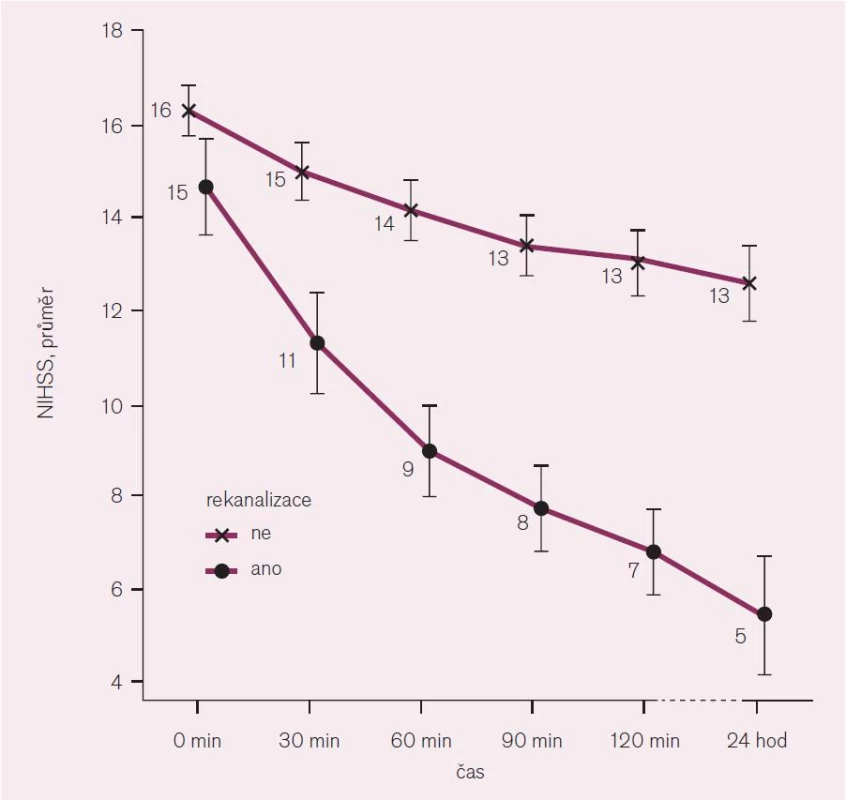
Klinické neurologické vyšetření však může mít, zejména v případě ischemické CMP, prognostický význam. V případě akutní cévní mozkové příhody stanovujeme na základě standardizovaného neurologického vyšetření tzv. NIHSS (The National Institute of Health Stroke Scale). NIHSS je škála mapující aktuální neurotopický deficit. Má 15 složek, kde jsou kvantifikovány jednotlivé komponenty neurologického vyšetření, jako jsou vědomí, řeč, motorika, senze, vizuální a cerebelární funkce (vlastní škálu lze najít na webové stránce: http://www.cmp.cz/public/f5/3d/81/4009_16400_formular_k_vyplnovani_nihss.pdf). Hodnota NIHSS koreluje s tíží mozkového infarktu, velikostí ischemického ložiska a v prvních 6 hod od vzniku je statisticky významným prediktorem výsledného stavu pacienta v sedmi dnech a třech měsících po mozkovém infarktu. Relativní změna NIHSS u pacienta s okluzí mozkové tepny koreluje se stupněm rekanalizace (obr. 1). Takto lze NIHSS využít k monitoraci efektu terapie [2–4].
Neurozobrazovací metody používané v diagnostice CMP
Počítačová tomografie
Stále nejrozšířenější zobrazovací metodou u diagnostiky CMP je počítačová tomografie (CT). Je to vyšetření široce dostupné, relativně levné a umožňuje snadno a rychle vyšetřit i pacienty v těžkém stavu. Dříve bylo jeho hlavním úkolem odlišit krvácení a eventuálně odhalit jinou etiologii klinických symptomů (tumor, kontuze apod.), neboť průkaz ischemie byl možný až po více než 24 hod či dokonce několika dnech. Nyní můžeme díky moderním CT přístrojům identifikovat časné ischemické změny v řádu hodin. V rámci multimodalitního CT vyšetření můžeme také ihned posoudit stav extra - i intrakraniálních tepen, rozsah okluze, kolaterálního oběhu a zobrazit perfuzní deficit včetně pravděpodobné penumbry jako reperfuzí zachranitelné mozkové tkáně [5].
Magnetická rezonance
Magnetická rezonance (MRI) se v poslední době dostává na první pozici i v zobrazení akutní CMP, a to zejména v hlavních centrech zaměřených na léčbu CMP. Dosud tomu ve srovnání s CT bránily některé jeho nevýhody (delší čas vyšetření, horší citlivost k akutnímu krvácení, větší sklon k artefaktům u neklidného pacienta, vyšší ekonomické náklady). Tyto nyní při stále se zlepšujících parametrech a zvětšujících se možnostech MRI vyšetření ustupují před jeho výhodami, kterými bezesporu je zejména vyšší citlivost ke změnám mozkového parenchymu a tedy ve většině případů vyšší diagnostická hodnota [1].
Diagnostika hemoragické CMP (intracerebrálního hematomu)
CT vyšetření a intracerebrální krvácení
Nativní CT mozku je stále považováno za zlatý standard pro diagnózu intracerebrálního krvácení, i když MRI má s ním v dnešní době srovnatelnou a u některých typů krvácení i lepší senzitivitu a specificitu (viz níže). Zajímavé je, že vlastně nikdy nebyla provedena žádná srovnávací studie (např. s operačními nálezy), která by jeho přesnost potvrdila na úrovni nejvyšší důkazní hodnoty (LoE A-level of evidence A) [1].
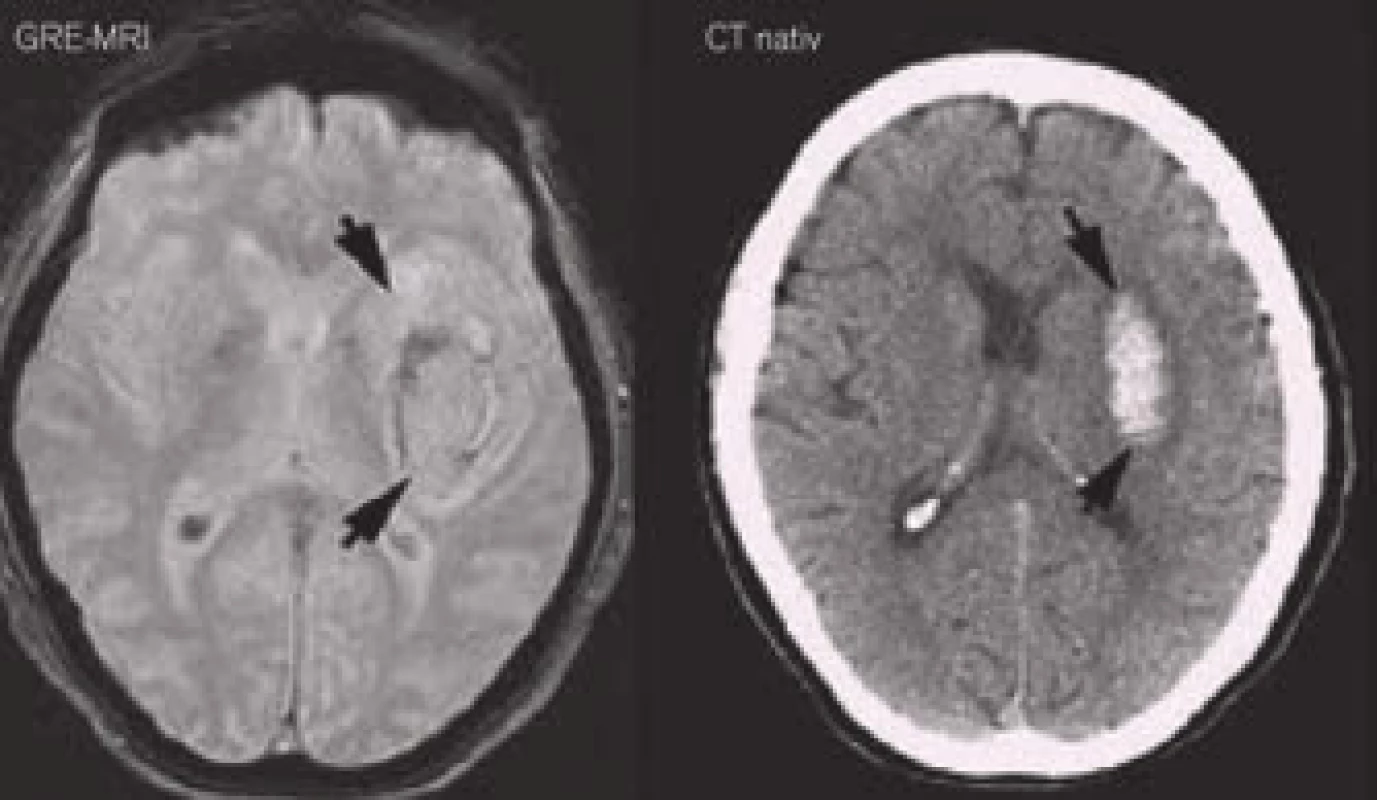
Hemoragie se v úplném počátku krvácení (hyperakutní fázi) zobrazuje jako ložisko o denzitě v rozsahu 30–60 HU (Hounsfield units) v závislosti na poměru krevních buněk a plazmy. V této fázi má obdobnou denzitu jako mozková tkáň. Lékař však při CT vyšetření již většinou pozoruje hyperdenzní krevní sraženinu o denzitě 60–100 HU, která vzniká v následných minutách až hodinách po ruptuře tepny [7]. Nicméně, někdy se při CT objeví v místě hyperdenzity proužek či malé ložisko, které je k okolnímu hematomu hypodenzní (resp. izodenzní s mozkovým parenchymem), tzv. swirl sign (obr. 2). Swirl sign představuje ještě stále proudící krev z prasklé tepny a ukazuje se, že se jedná o nezávislý prediktor smrti a špatného klinického stavu pacienta ve třech měsících. Jeho identifikace tak může ovlivnit terapeutický přístup ve smyslu agresivnější hemostyptické terapie [8].
![„Swirl sign“ (šipka) představující proudící krev z tepenné ruptury [8].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/7fad787b949845e55abb8fd3e93fc5d5.jpg)
Velikost intracerebrálního hematomu (ICH) se udává v ml či cm3. Vypočítá se jako polovina součinu jeho nejširších rozměrů na ose x, y, z. Jeho objem má rovněž prediktivní hodnotu. Velikost nad 60 cm3 spolu se vstupním Glasgow coma scale pod 8 byla spojena s 91% mortalitou. Naopak velikost pod 30 cm3 predikuje pouze 19% úmrtnost [9].
Při nálezu ICH je vhodné doplnit CT angiografické vyšetření intrakraniálních tepen za účelem vyloučení aneuryzmatu či cévní malformace. Na zdrojových snímcích může být patrný tzv. spot sign (až ve 30 %), což je relativně hyperdenzní drobný útvar způsobený extravazací kontrastní látky (funkčně se jedná o obdobu swirl sign). Jeho přítomnost je opět prediktorem progrese krvácení a špatné prognózy (43% úmrtnost oproti 19% u pacientů bez spot sign) [10]. Někdy se doplní spíše kontrastní CT vyšetření, nejčastěji v případech, kdy je podezření např. na prokrvácený tumor (to již bývá spíše nahrazováno přesnějším MRI vyšetřením).
Lokalizace intracerebrálního hematomu může zase ukazovat na pravděpodobnou etiologii. Subkortikální hematomy v oblasti bazálních ganglií (event. i v mozečku) jsou nejčastěji způsobeny rupturou tepny poškozené v důsledku hypertenzní arteriolopatie (tzv. typický ICH). Kortikální (lobární) hematomy mohou vznikat právě při přítomnosti např. cévní malformace, tumorózní formace (spíše u mladších pacientů) či při tzv. amyloidní angiopatii (v podstatě degenerativní arteriolopatie charakterizovaná opakovanými jak hemoragiemi, tak ischemickými ikty u starších pacientů).
MRI mozku a intracerebrální krvácení
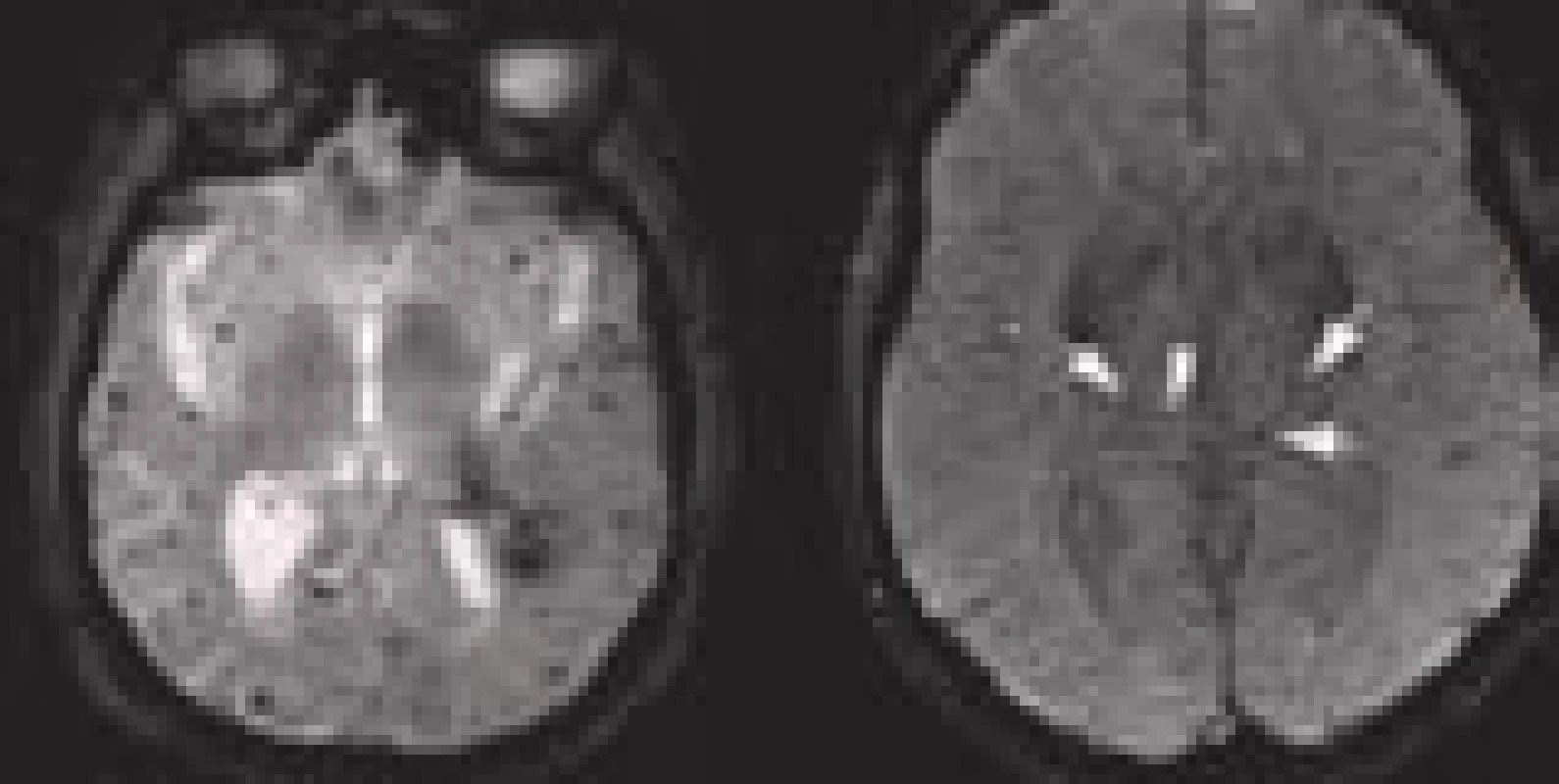
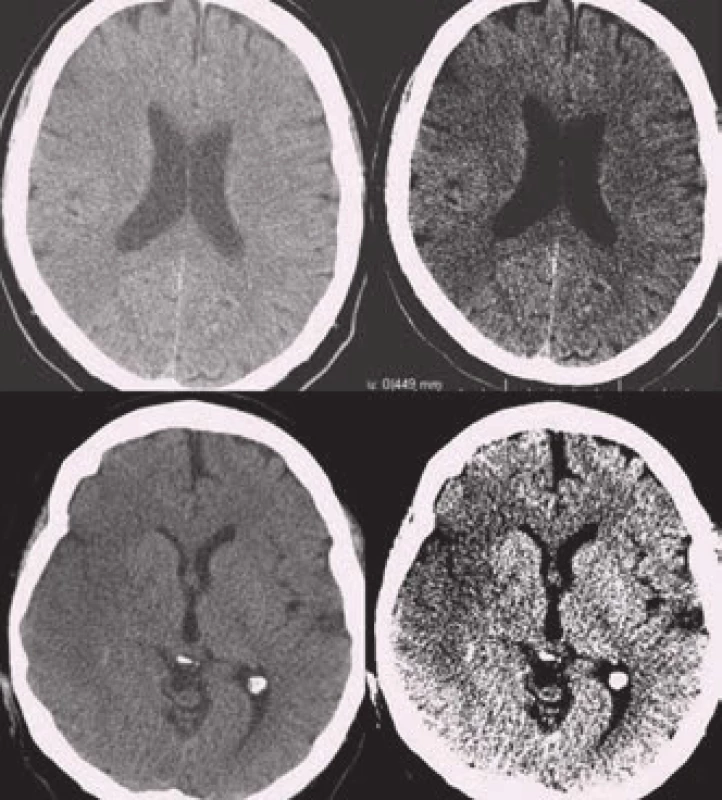
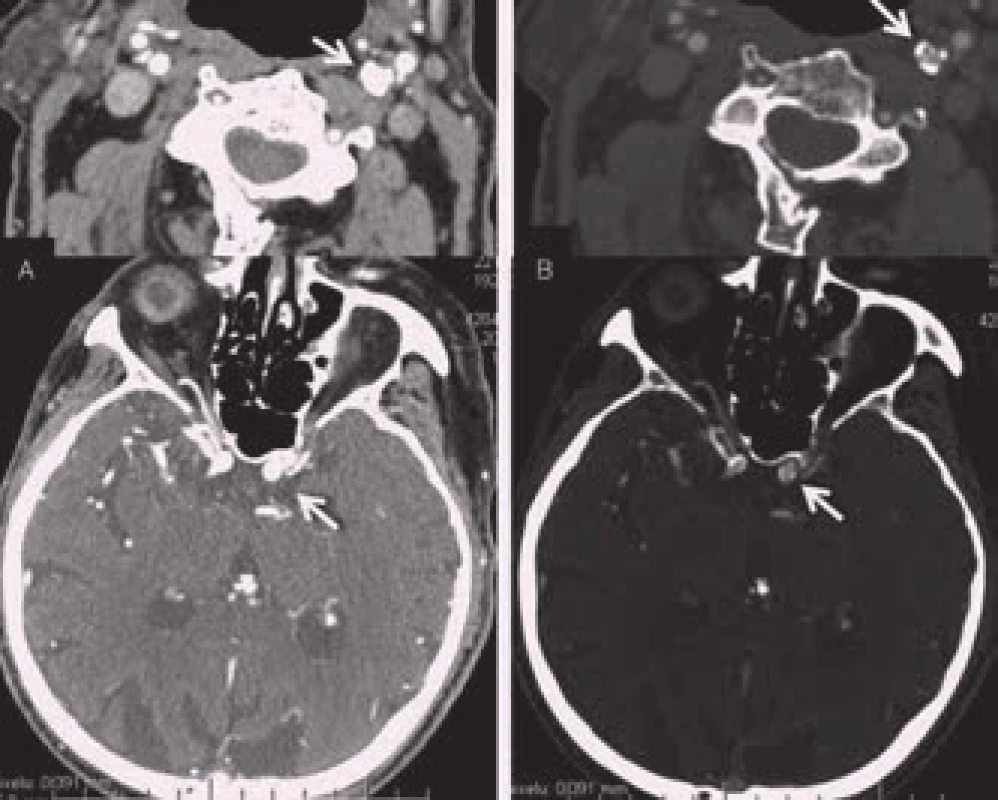
Zobrazení akutního krvácení bylo donedávna Achillovou patou magnetické rezonance ve zhodnocení akutní cévní mozkové příhody. Viditelnost krvácení na MRI je závislá na zastoupení oxyhemoglobinu, jeho rozpadových produktů a celistvosti membrány erytrocytů. Běžné T1 a T2 snímky detekují spolehlivě jen subakutní a chronické krvácení. U hyperakutního krvácení (cca 1. hod) se někdy může objevit v T2W obrazech lehký hypointenzní lem na periferii hematomu. Je způsobený již přítomným deoxyhemoglobinem. Citlivějším zobrazením je varianta T2 zobrazení tzv. gradientní echo sekvence (GRE), resp. echo planar images (EPI) patřící do skupiny SWI – susceptibility weighted images. Krvácení se projevuje jako hypointenzní léze již v prvních hodinách [6]. Těmito sekvencemi lze detekovat jakékoli krvácení, a to se stejnou senzitivitou jako při použití CT (obr. 3) [11].
MRI vyšetření tak lze použít spolehlivě i jako vstupní vyšetření u pacientů s podezřením na CMP. MRI (GRE) je dokonce senzitivnější k detekci staršího krvácení než CT vyšetření [11]. Zobrazí i drobné perivaskulární hemoragie – tzv. mikrohemoragie, které na CT nejsou detekovatelné (obr. 4). Obraz mikrohemoragií na MRI je způsoben depozitami hemosiderinu, které přetrvávají v tkáni velmi dlouho a jsou obrazem kumulace drobných perivaskulárních krvácení. Vyskytují se u arteriolopatického postižení (např. u 80 % pacientů s amyloidní angiopatií, ale také u 7–8 % zdravé starší populace) a mohou být vedlejším nálezem také u pacientů s akutní ischemickou CMP indikovaných k trombolytické terapii. Vyšší riziko krvácivých komplikací trombolytické terapie v případě nálezu malého množství (pod pět) mikrohemoragií se neprokázalo [12]. Pro nález většího počtu mikrohemoragií nejsou dostupná data.
Diagnostika ischemické CMP
Nativní CT
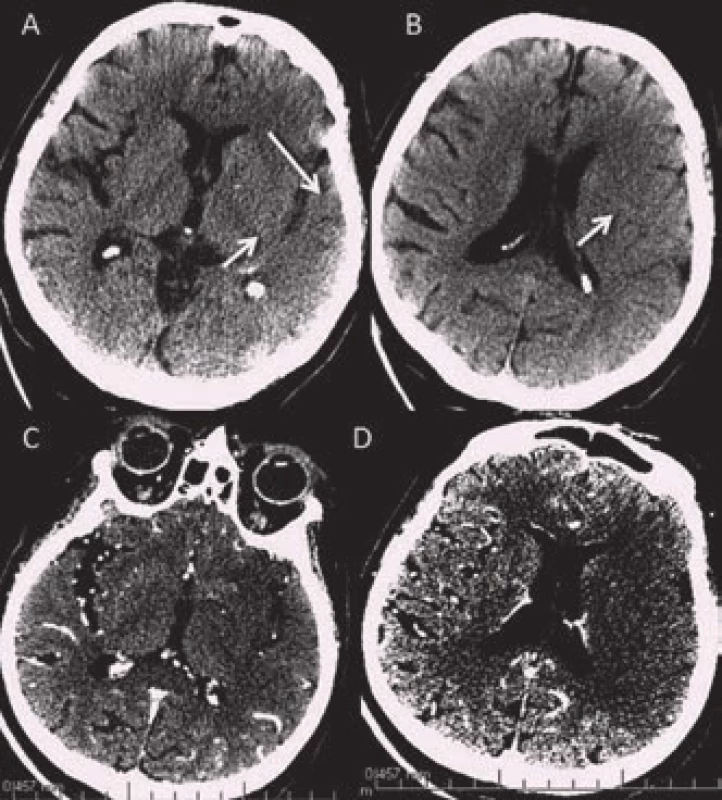
Ischemické změny se na CT obraze objevují v závislosti na délce trvání ischemie a jejich rozsah pak závisí na parametrech tepenného uzávěru (lokalizace, rozsah) a stavu kolaterálního oběhu. Často se již v prvních šesti hodinách objevují změny parenchymu poukazující na probíhající ischemizaci tkáně. V hypoxické tkáni dochází v důsledku rychlého poklesu buněčných zásob glukózy a kyslíku k selhání Na/K pump a k přesunu vody do intracelulárního prostoru. Tento cytotoxický edém se v CT obraze projevuje jako tzv. časné známky ischemie. Čím dříve dojde k rozvoji časných známek, tím závažnější ischemii lze předpokládat.
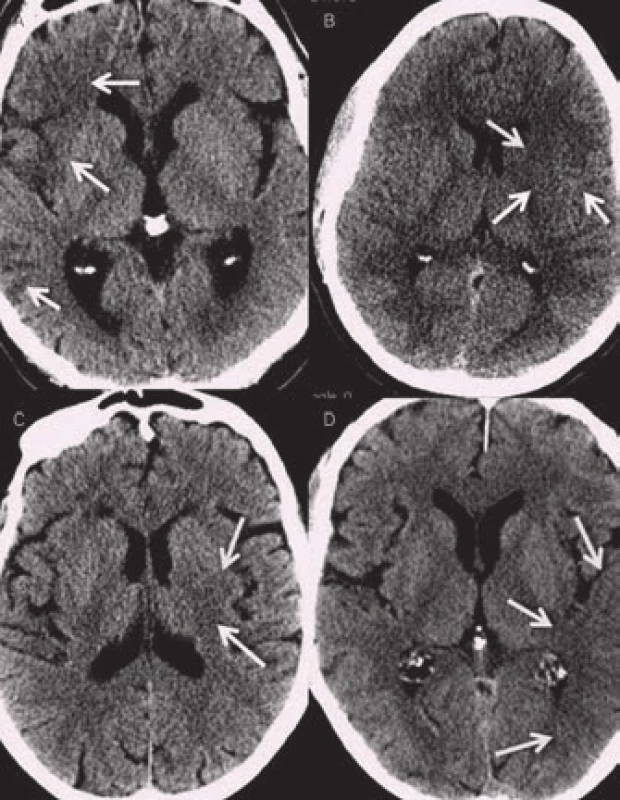
Mezi časné známky ischemie patří setření kortikomedulárního rozdílu neboli setření hranic mezi kortikální a subkortikální vrstvou parenchymu. To se nejčastěji projeví jako absence tzv. inzulární stužky (obr. 5) či setření hranic mezi ncl. caudatus a lentiformis a okolní bílou hmotou. Dále se na konvexitě objevuje setření hranic kortexu a vyhlazení gyrifikace. Edém vrcholí za 48 až 72 hod a v závislosti na jeho rozsahu může dojít až k přetlaku středočarových struktur. Pokročilá fáze nekrózy mozkové tkáně se rozvíjí přibližně po 8 hod a je dokončena kolem 24 hod od vzniku. Na CT se zobrazuje jako hypodenzní oblast. Senzitivita detekce časných známek bývá udávána kolem 70 % (rozmezí 20–87 %) a specificita 87 % (rozsah 56–100 %) [13,14]. Rozpoznání časných známek je silně závislé na zkušenosti hodnotícího lékaře. K lepší detekci časných známek přispívá vyšší kvalita zobrazení u nových CT přístrojů a dále možnost softwarové úpravy parametrů okna (kontrast, stupně šedi apod.) (obr. 6) [15].
Časné známky ischemie odpovídají hypoxické tkáni, kterou už není možné úspěšnou reperfuzí zachránit. Jejich přítomnost ve větším rozsahu zvyšuje riziko hemoragické transformace při reperfuzní terapii a je spojena s horším výsledným klinickým stavem ve srovnání s pacienty, kteří tyto časné známky nemají [16,17]. Na druhou stranu však z analýz studií NINDS a ECASS vyplývá, že pacienti s časnými známkami ischemie menšího rozsahu mají, i přes vyšší riziko hemoragické transformace, statisticky významný prospěch z trombolytické terapie ve srovnání s placebovou skupinou. Časné známky ischemie menšího rozsahu (ve studii ECASS byla hranicí 1/3 povodí a. cerebri media) tedy nejsou kontraindikací podání trombolytické terapie.
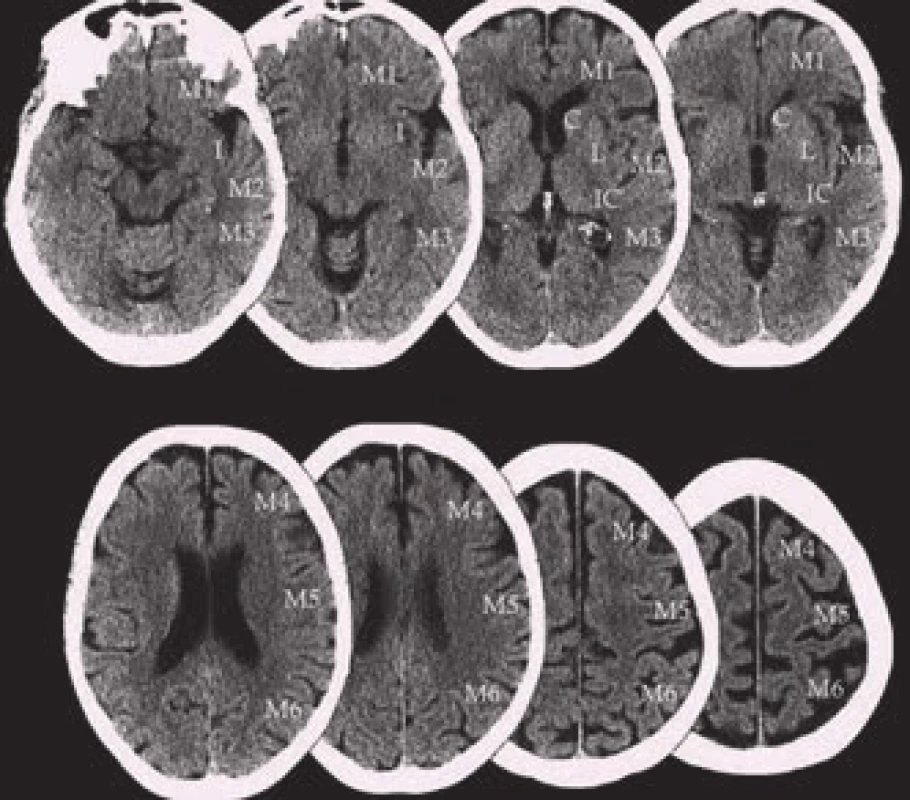
Ke standardizaci a vyšší spolehlivosti hodnocení časných ischemických známek slouží škála ASPECTS (Alberta Stroke Program Early CT Score) [18]. Jedná se o 10bodové hodnocení CT v segmentech zásobovaných a. cerebri media (ACM). Hodnotíme ncl. caudatus (C), ncl. lentiformis (L), capsula interna (IC), inzulu (I) a úseky M1–M6. M1–M3 jsou ve výši bazálních ganglií, M4–M6 ve výši postranních komor nad bazálními gangliemi (obr. 7). Normální nález skórujeme 10, je-li v dané oblasti známka ischemie, odečte se vždy jeden bod. ASPECT skóre koreluje se vstupní hodnotou NIHSS (National Institutes of Health Stroke Scale) a umožňuje predikci výsledného stavu i rizika symptomatické hemoragie. Horší výsledek lze očekávat u skóre 6 a méně, naopak 7 a více bodů predikuje dobrou odpověď na reperfuzní terapii (až třikrát vyšší šance na dosažení nezávislosti oproti 6 a méně bodům) [19]. ASPECTS hodnotí primárně povodí ACM, při hodnocení nativních snímků však pátráme i po změnách v povodí a. cerebri anterior (ACA), a. cerebri posterior (ACP) nebo v zadní jámě. ASPECTS lze hodnotit i na CT perfuzních skenech [20].
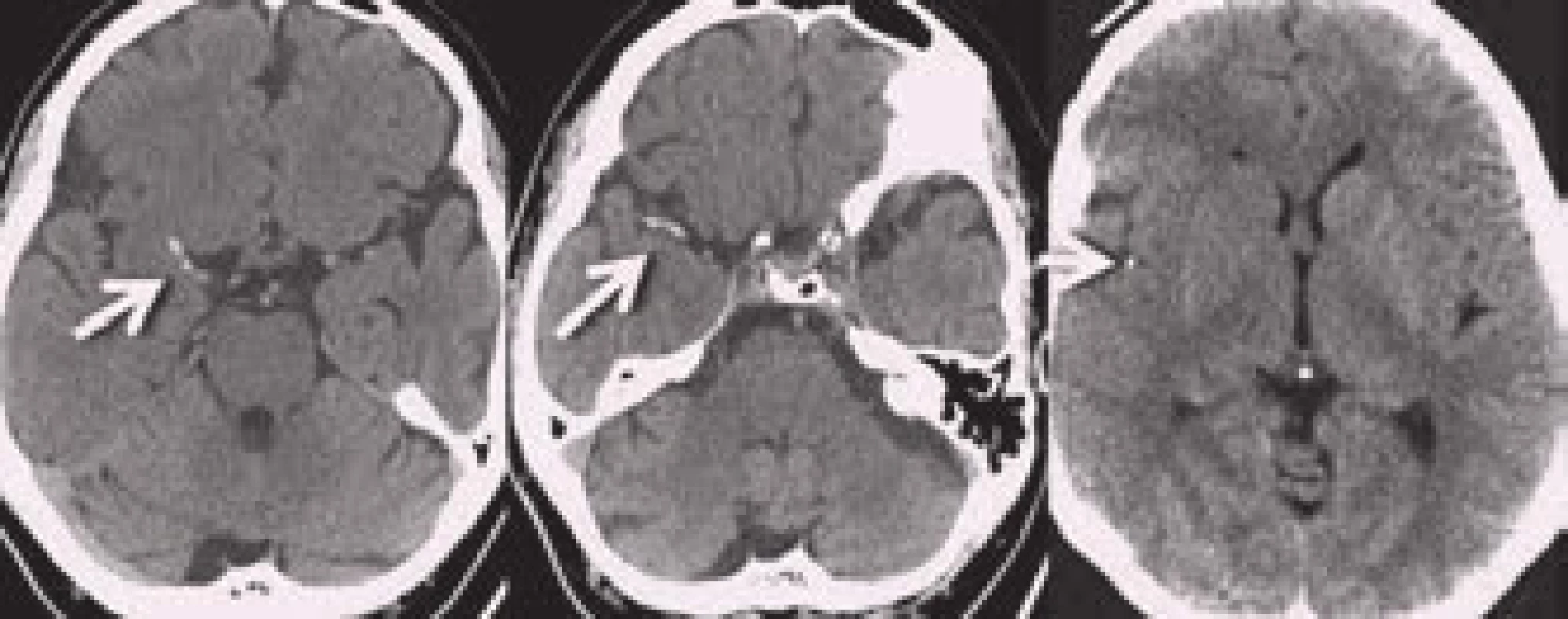
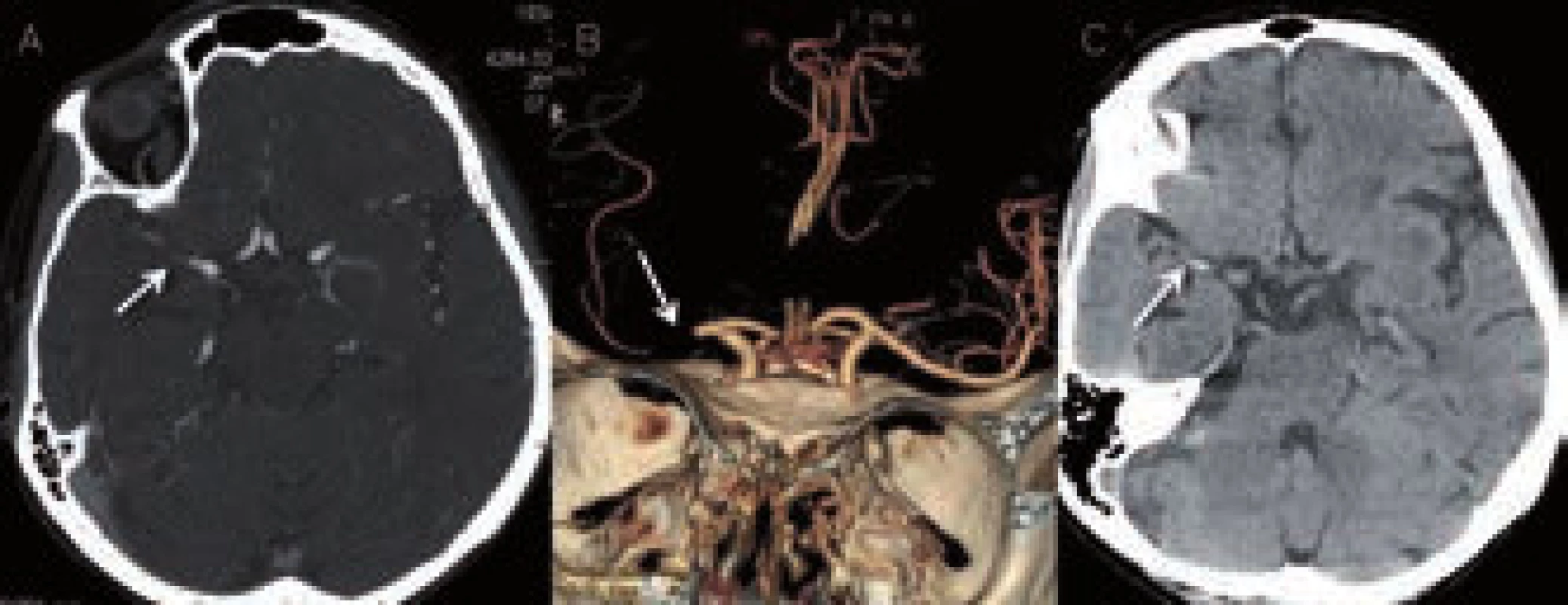
Neméně významným nálezem na nativním CT je i tzv. znamení denzní arterie (dense artery sign – DAS). Jedná se o hyperdenzní úsek tepny v místě její okluze (obr. 8). Její výskyt u akutní CMP je udáván v širokém rozmezí 5–59 % [21]. Čím tenčí CT řezy, tím větší záchyt DAS. Falešně pozitivní nález může být způsoben vysokým hematokritem, polyglobulií či kalcifikacemi ve stěně tepny. Případnou okluzi potvrdí následná CT angiografie. Důležité je pátrat po DAS v periferních úsecích („dot sign“ v místech M2 větví – viz obr. 8), neboť zde je CT angiografie méně přehledná.
Kvantitativním i kvalitativním hodnocením trombů na nativním CT se v současnosti zabývá řada autorů. Velikost trombu predikuje pravděpodobnost rekanalizace trombolytické terapie [23]. V souboru 138 trombolyzovaných pacientů s okluzí ACM nedošlo u žádného z pacientů s trombem delším než 8 mm k rekanalizaci [22].
Multimodalitní CT vyšetření
CT perfuze
CT perfuze (CTP) je modalita, která může být využita k posouzení aktuálního prokrvení mozkové tkáně a její viability. S její pomocí lze identifikovat a hodnotit ischemizovanou oblast již v časných stadiích mozkového infarktu a za určitých okolností lze s pomocí CTP identifikovat přibližný rozsah jádra infarktu a penumbry [27]. CT perfuzí zjištěná přítomnost penumbry může pomoci určit pacienty, u nichž bude prospěch rekanalizační terapie převyšovat nad jejími riziky.
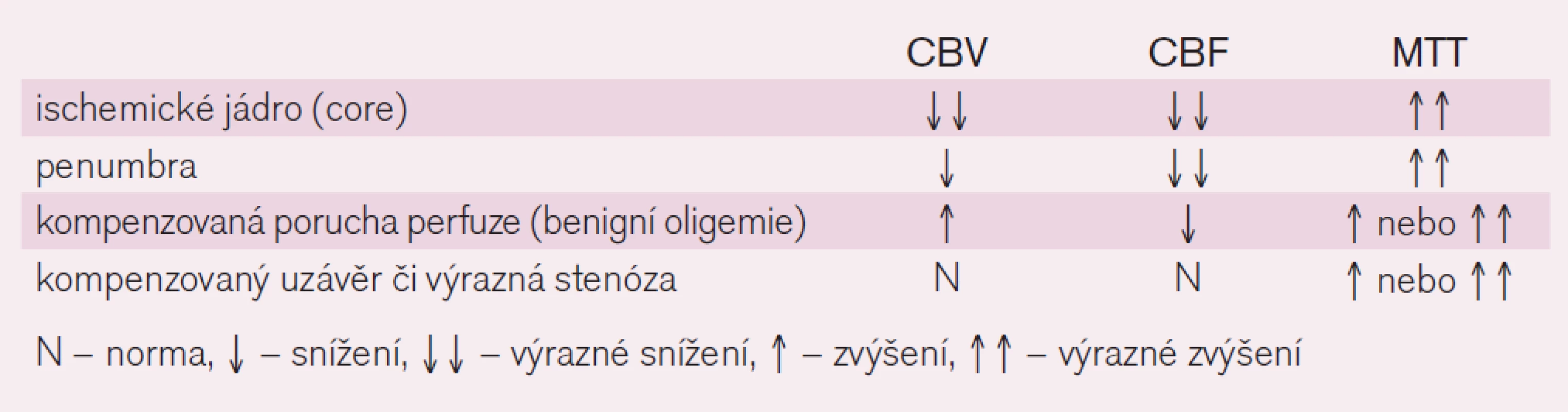
Po aplikaci jodové kontrastní látky dojde k přechodnému zvýšení denzity parenchymu úměrně množství kontrastní látky v cévním řečišti dané oblasti. Softwarovým zpracováním naměřené denzity mozkové tkáně při prostupu kontrastní látky získáme čtyři parametry. Jsou jimi Cerebral Blood Volume (CBV), který udává množství krve v určitém objemu tkáně (v ml/100 mg tkáně), Cerebral Blood Flow (CBF), udávající hodnotu průtoku krve (ml/100 g tkáně/min), mean transit time (MTT), což je průměrný čas arteriovenózního přechodu krve daným objemem tkáně (v sekundách), a time to peak (TTP), který určuje průměrný čas do maximální denzity ve snímané oblasti (v sekundách). Vzájemný vztah uvedených parametrů je vyjádřen rovnicí: CBF = CBV/MTT, která je rovněž rovnicí autoregulační schopnosti mozkového řečiště (při zhoršení průtoku – např. stenóze či okluzi – dojde k prodloužení MTT a autoregulací k postobstrukční vazodilataci – zvýšení CBV – tak, aby hodnota CBF neboli průtoku byla zachována).
Číselná hodnota CBV je získána jako výpočet plochy pod perfuzní křivkou, relativní hodnota MTT je získána jako polovina doby mezi časem od vzestupu denzity z bazální úrovně po její pokles zpět na bazální úroveň. Na základě naměřených a vypočtených hodnot se potom vytváří barevné perfuzní mapy pro jednotlivé parametry, kde lze oblasti s rozdílným prokrvením od sebe odlišit a jejich rozsah porovnat.
Při hodnocení se doporučuje začínat parametrem MTT (event. TTP), který se u ischemizace prodlužuje a který regionální abnormity zobrazuje nejvýrazněji. Nicméně není vhodný pro posouzení aktuální viability mozkové tkáně, protože pouze identifikuje rozsah obturovanou tepnou zásobené oblasti, kde dochází k pomalejšímu, resp. nedostatečnému plnění kontrastní látkou. Tato oblast v sobě zahrnuje jak jádro infarktu, tak penumbru, tak i oblast tzv. benigní oligemie, která ani při perzistující ischemizaci nekróze nepropadá.
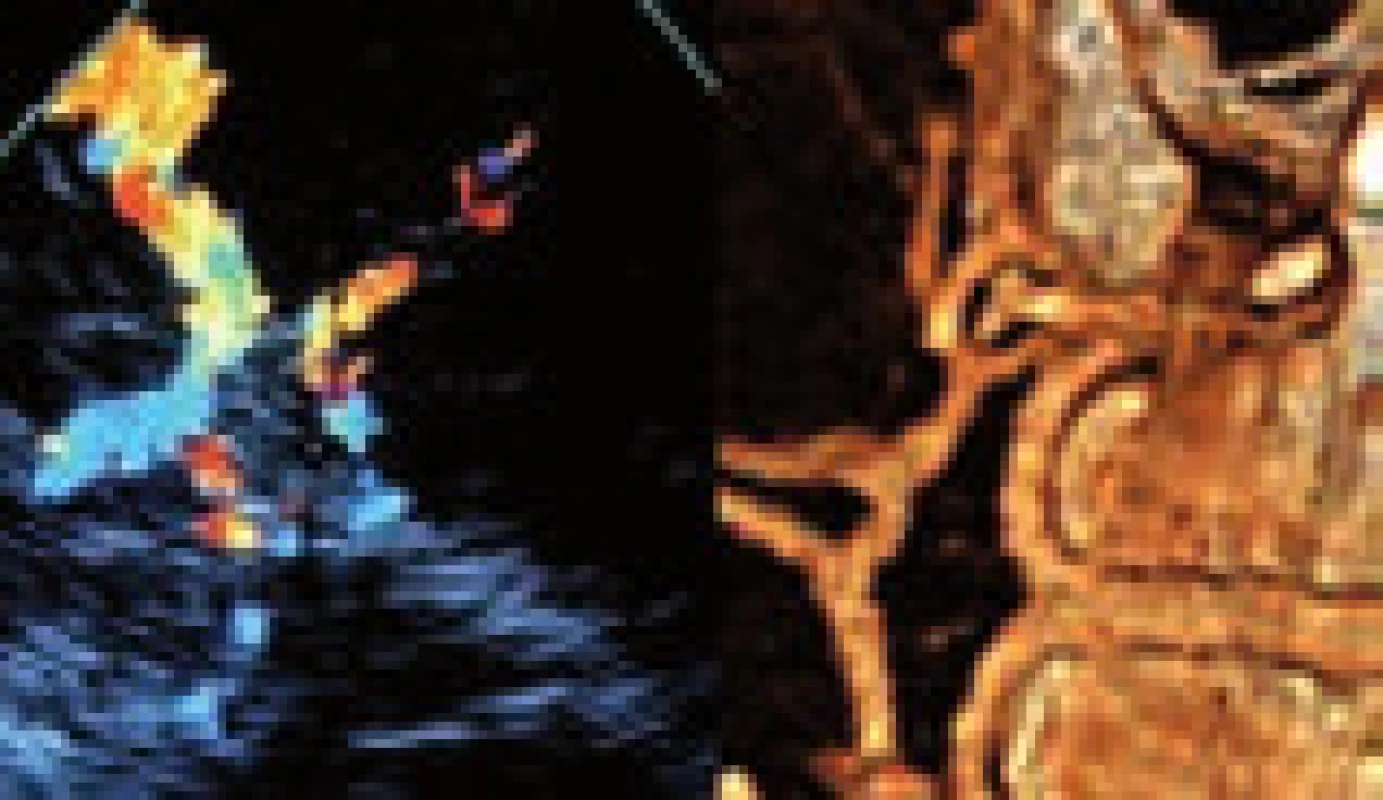
K odlišení jádra infarktu od penumbry lze použít parametry CBF a CBV [24,25]. Optimální protokol se zatím hledá, nicméně se ukazuje, že ve tkáni se sníženou hodnotou CBV pod 2 ml/100 g tkáně dojde v 99 % k rozvoji infarktu. Objem tkáně s poruchou perfuze v podobě prodlouženého MTT (> 145 %) či sníženého CBF (65 % a méně) představuje celkovou, ischemií ohroženou oblast [25]. Kolaterálami dostatečně zásobená oblast tkáně za okluzí tepny bude mít sice prodloužené MTT, ale normální či zvýšené CBV a podhraničně snížené CBF. Nicméně i tak dochází často k nadhodnocení rozsahu penumbry zahrnutím i oblastí s benigní oligémií. Určení přesného rozsahu penumbry se tím komplikuje a jak MR, tak CT perfuze často rozsah penumbry nadhodnocují [26]. Zjednodušeně však lze penumbru určit jako rozdíl rozsahu tkáně potenciálně infarktem ohrožené (CBF) a rozsahu tkáně infarktem již postižené (CBV), tedy CBF − CBV (CBF/CBV mismatch) [27] (obr. 9 a 10).
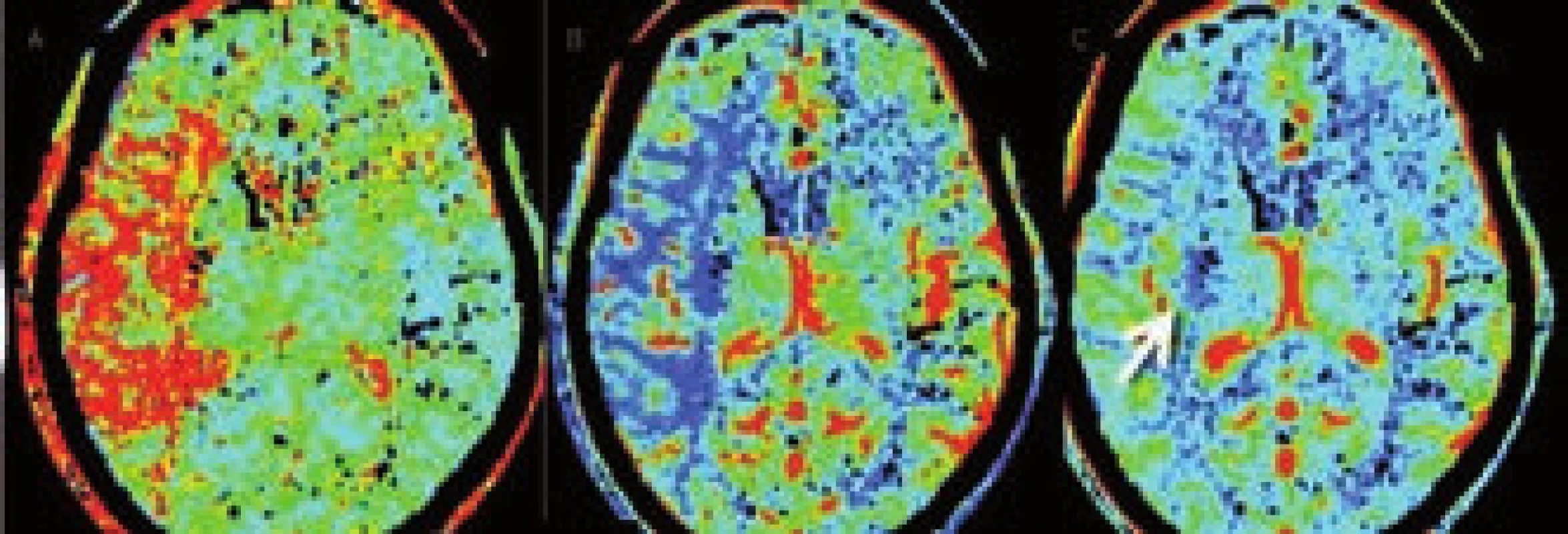
Několik studií s MR prokázalo dobrou korelaci léze v CBV se zobrazením na MR DWI (diffusion weighted images) [24,28]. Byly ale referovány i ojedinělé nálezy reverzibility CBV a DWI lézí [28,29]. Oblasti s výrazně prodlouženým TTP bývají patrny u cévních uzávěrů. Pokud jde o chronický stav, je v této oblasti přítomna normální hodnota CBV a CBF (obr. 11). Přehled nálezů na CT perfuzi je uveden v tab. 1.
Limitací CT perfuze byla dosud relativně malá oblast (cca 4cm vrstva mozkové tkáně), kterou bylo možno vyšetřit, nicméně s novými multidetektorovými CT přístroji se tato vyšetřitelná oblast zvětšuje a na 256 detektorových CT přístrojích lze již vyšetřit celý mozek. Většinou se tedy vyšetřuje maximální možný rozsah kolem řezu na úrovni bazálních ganglií, kde se nejlépe zobrazí ischemie v povodí ACM. Vyšetření lze nastavit i na oblast zadní jámy, je zde ale třeba počítat s četnějšími artefakty.
Využití konceptu CTP mismatche v klinické praxi naráží na některé technické problémy. I po letech výzkumu nejsou k dispozici přesné a validizované hranice k odlišení penumbry a jádra. Při klasickém matematickém zpracování CTP (dekonvoluce) se počítá s jednorázovým průchodem kontrastní látky vyšetřovanou oblastí. V praxi je však často v důsledku stenóz a/nebo kolaterálního oběhu přítok kontrastní látky více rozptýlen v čase a tím dochází k nadhodnocení CBV a CBF. Využití upraveného algoritmu s korekcí zpoždění vyžaduje změnu a validaci hraničních hodnot [30]. Navíc výrobci softwaru pro CTP používají ke zpracování map různé variace matematického modelu. Výsledky se tedy mohou u různých programů lišit i při identických hraničních intervalech. Trombolytickou terapii mimo časové okno na základě průkazu perzistující penumbry je nutno považovat za experimentální postup. Aktuálně probíhá řada studií, v nichž jsou pacienti léčeni na základě průkazu viabilní tkáně pomocí MR nebo CT.
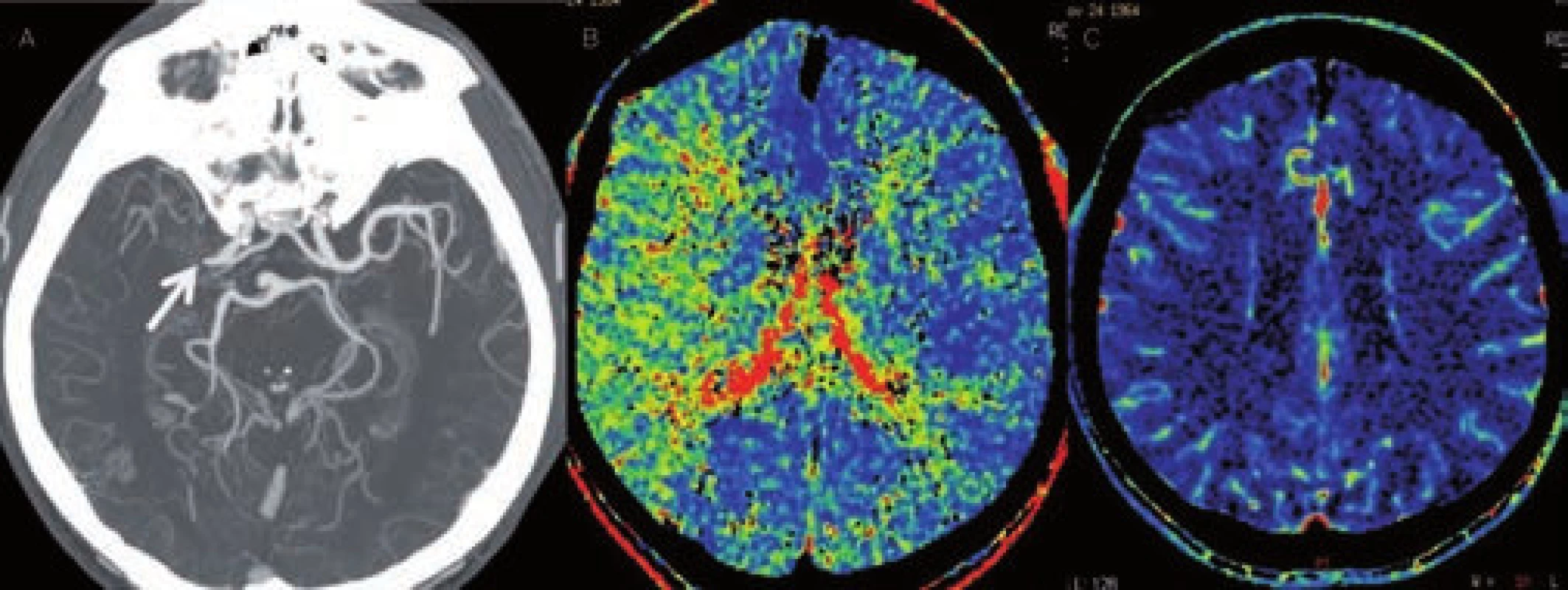
CT angiografie
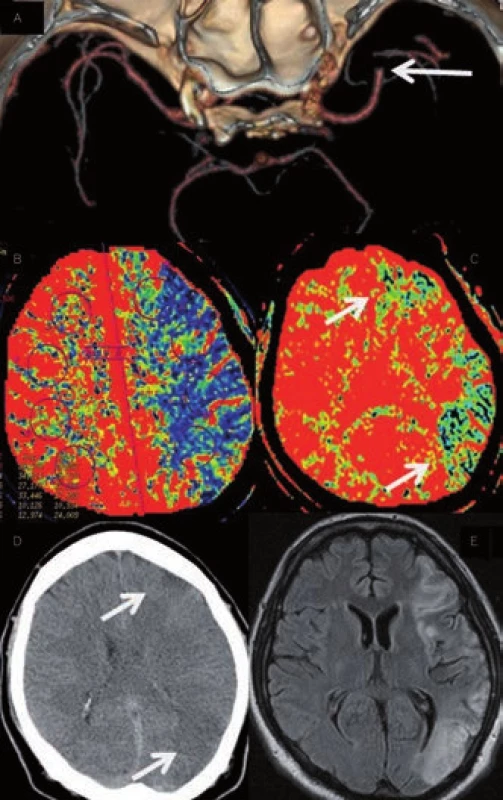
Hlavním úkolem CT angiografie (CTA) je zobrazení stavu extra - i intrakraniálních tepen a vyšetření se standardně provádí od aortálního oblouku po vertex (obr. 12, 13). Zajímá nás lokalizace a rozsah stenózy/okluze i jejich povaha (ateroskleróza, disekce) a dále stav kolaterálního řečiště. Vyšetření má nižší senzitivitu u patologií v distálním větvení mozkového řečiště, u lakunárních infarktů a nelze jej využít k odlišení jádra infarktu a penumbry. Velmi výhodné je naopak v diagnostice patologií ve vertebrobazilárním povodí včetně detekce okluze a. basilaris. Především při hodnocení zdrojových snímků je často nutná úprava parametrů „width“ a „level“ ke zhodnocení např. kalcifikovaných stenóz (obr. 14). Ideální parametry se u různých přístrojů liší.
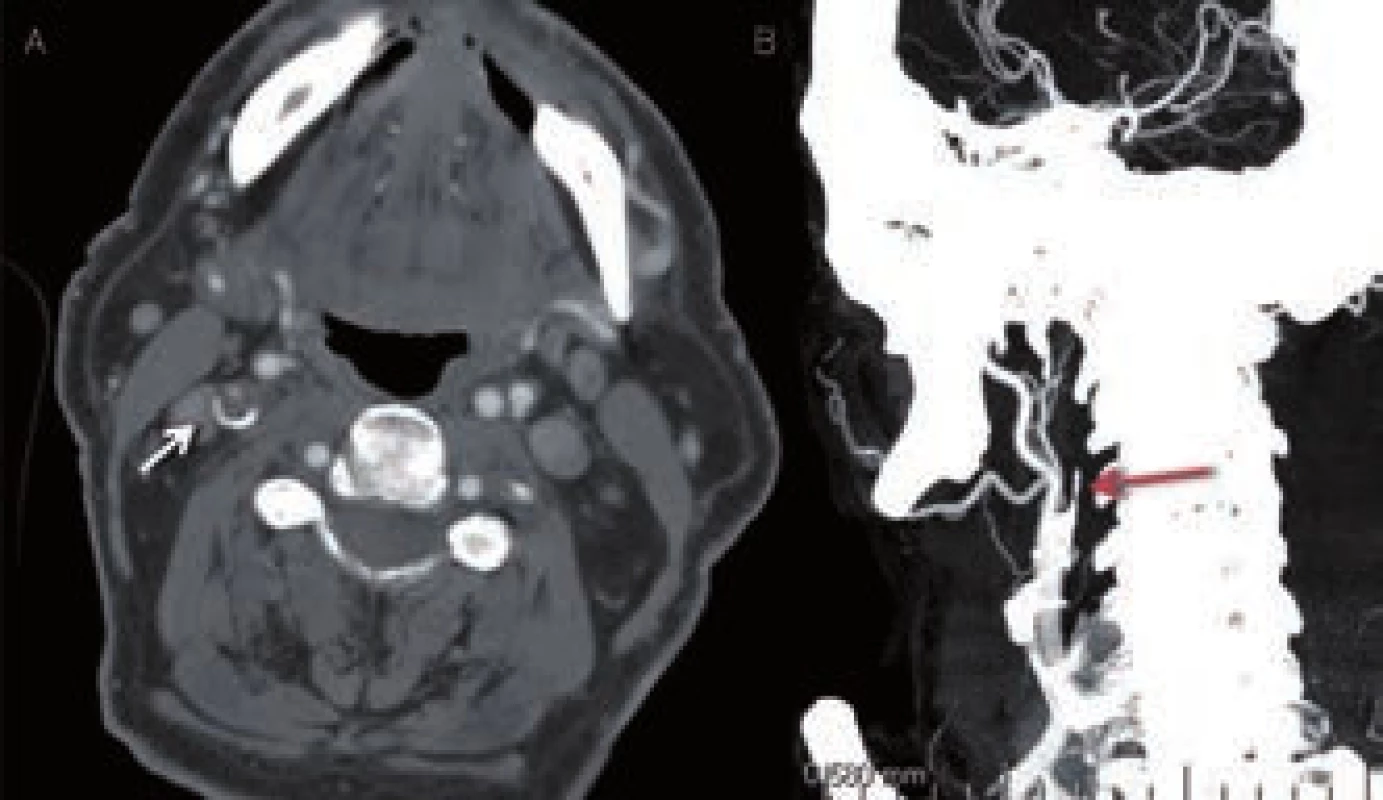
Při CT angiografii dochází po bolusovém podání jodové kontrastní látky k vytvoření dvou - a třírozměrného zobrazení tepenného, resp. žilního řečiště. Senzitivita a specificita CTA ve srovnání s digitální subtrakční angiografií (DSA) a MR angiografií (MRA) se v detekci stenóz a okluzí hlavních mozkových tepen pohybuje mezi 89–99 % [31], i když MRA v porovnání s CTA poněkud tíži stenózy nadhodnocuje [32].
K přesnějšímu posouzení rozsahu trombózy v přední cirkulaci škály byla navržena škála Clot Burden Score (CBS). Skóre 10 značí normální nález, přítomnost trombu v supraklinoidním úseku ACI a v M1 úsecích (proximálním a distálním) snižuje skóre vždy o 2 body, trombus ve větvích M2, v ACA a infraklinoidním úseku ACI snižuje skóre o 1 bod (obr. 15) [33]. Clot burden score < 10 je asociováno s menší šancí na dobrý výsledný klinický stav. Ve srovnání s CBS 10 je poměr šancí (odds ratio – OR) 0,09 pro CBS ≤ 5; 0,22 pro CBS 6–7 a 0,48 pro CBS 8–9. Nižší CBS skóre bývá také asociováno s nižší hodnotou ASPECTS a vyšším výskytem hemoragických komplikací [34].
CTA umožňuje také analýzu kolaterálního oběhu. K jeho hodnocení můžeme použít jednoduchou škálu Collateral Score (CS): 0 = žádné kolaterály, 1 = kolaterály zásobující ≤ 50 % ischemizované oblasti, 2 = zásobení > 50 % a < 100 %, 3 = kompletní kolaterální zásobení (obr. 16) [33]. Bylo prokázáno, že přítomnost dobrého kolaterálního oběhu koreluje s menším jádrem infarktu a predikuje lepší výsledný klinický stav při reperfuzní terapii [35].
![Collateral score [33].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/9d3469ff063d10c93eec04edfb8039ed.jpg)
Kromě hodnocení vlastní okluze lze zdrojové snímky CT angiografie využít i k orientačnímu zhodnocení perfuzního deficitu (zvlášť pokud CTP není součástí standardního vyšetřovacího protokolu). Kontrastní látka vyplní kapiláry v normálně perfudované tkáni, ale bude chybět v ischemizované oblasti a tato se bude jevit jako hypodenzní. K optimálnímu zobrazení je opět potřeba upravit parametry okna (obr. 17).
Magnetická rezonance včetně multimodalitních vyšetření
Při indikaci MRI vyšetření s cílem vizualizovat hyperakutní ischemii je nutno požadovat specifické sekvence. Rutinně při MRI vyšetřeních používané T1, T2 vážené snímky a FLAIR (fluid-attenuated inversion recovery) jsou totiž na tato časná stadia ischemie málo citlivé a změny se na nich ještě neprojeví. Zde totiž teprve za 2–4 hod po začátku příznaků dochází, obdobně jako u CT, k diskrétnímu zastření či vyhlazení gyrifikace na T1 snímcích v důsledku počínajícího cytotoxického edému. Za 8–24 hod se v důsledku rozvoje edému postupně objevuje nejprve hyperintenzita v T2 a posléze i hypointenzita v T1 snímcích. Tyto změny se s ústupem edému zmenšují a po jeho odeznění přetrvávají nadále jen v místech infarktově změněné tkáně (obr. 18).
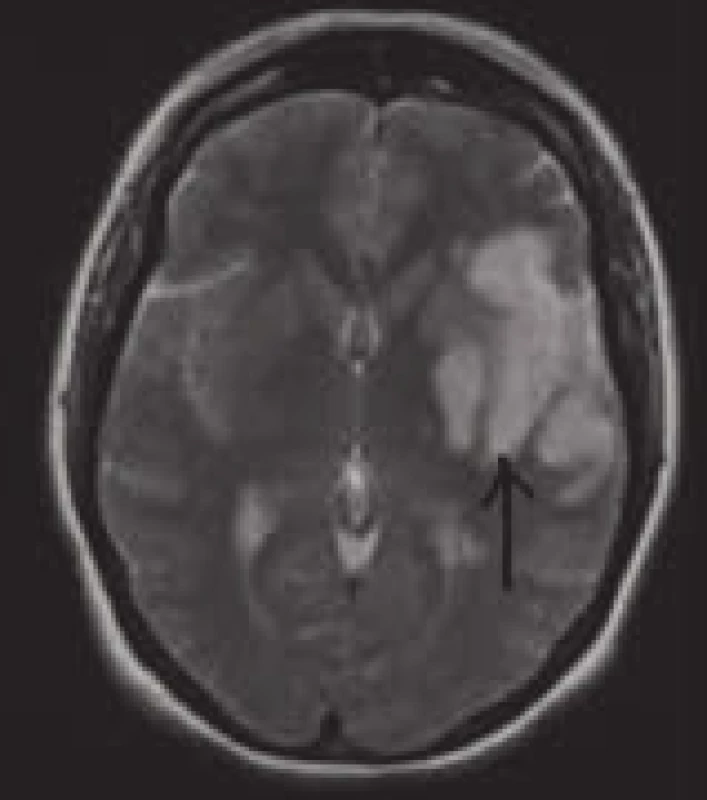
Důležité je podotknout, že v případech podezření na kmenovou ischemii, popř u tzv. minor stroke, kde je jen lehký neurologický deficit s obtížnou topizací i určením etiologie (typickým příkladem jsou vestibulární syndromy), by měla být MRI metodou první volby. Toto vyšetření posune diagnostiku výrazně kupředu ať už identifikací drobné ischemické léze, která by na CT vyšetření patrná nebyla, či jejím vyloučením. Klinik tak získá velmi důležitá data pro další postup.
MRI – difuzně vážené snímky
K identifikaci hyperakutní ischemie (v 1. hod od vzniku) jsou nejcitlivější tzv. difuzně vážené snímky (DWI) [36,37]. Princip DWI spočívá ve vizualizaci porušeného transportu (difuze) molekul vody (resp. protonů), ke kterému při ischemii mozkové tkáně dochází v důsledku energetického selhání sodno-draselných membránových pump. DWI je vysoce senzitivní pro záchyt akutního mozkového infarktu již za několik minut po jeho vzniku, což se projeví rozvojem hyperintenzní DWI léze. Následně pak v dalších 7–10 dnech dochází k jeho normalizaci a později dokonce k přechodu do obrazu inverzního (hypointenzita) (obr. 19).
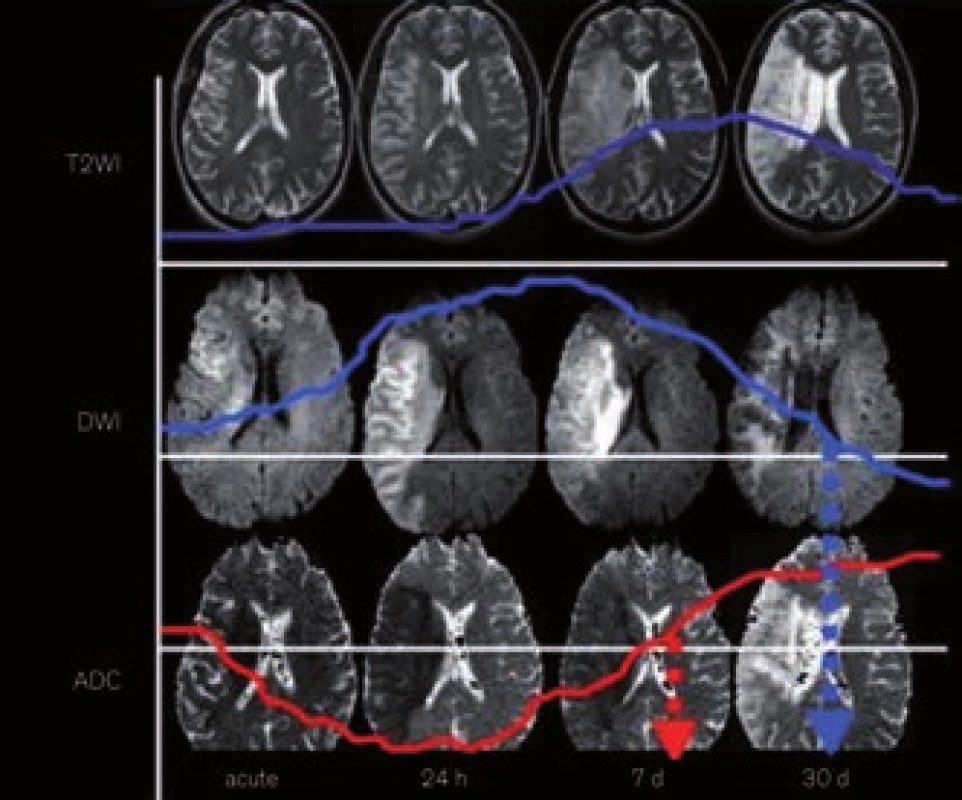
Rozsah akutní DWI léze odpovídá přibližně velikosti v té chvíli již ireverzibilně postižené tkáně (tento fakt ovšem neplatí zcela, neboť někdy dochází při časné rekanalizaci k normalizaci části původní velikosti DWI léze) [38,39]. Specificita tohoto vyšetření je omezena, neboť obdobné změny se mohou objevit i při jiném postižení transportních mechanizmů mozkové buňky, např. při zánětu, lymfomu, hemiplegické migréně, TGA, status epilepticus. Senzitivitu a specificitu vyšetření také může snižovat tzv. „shine-through“ fenomén, kdy se do DWI mapy „prosvítí“ výrazná hyperintenzita třeba starého data či jiné etiologie z T2 sekvencí (DWI je od T2 odvozena) (obr. 20) [40].
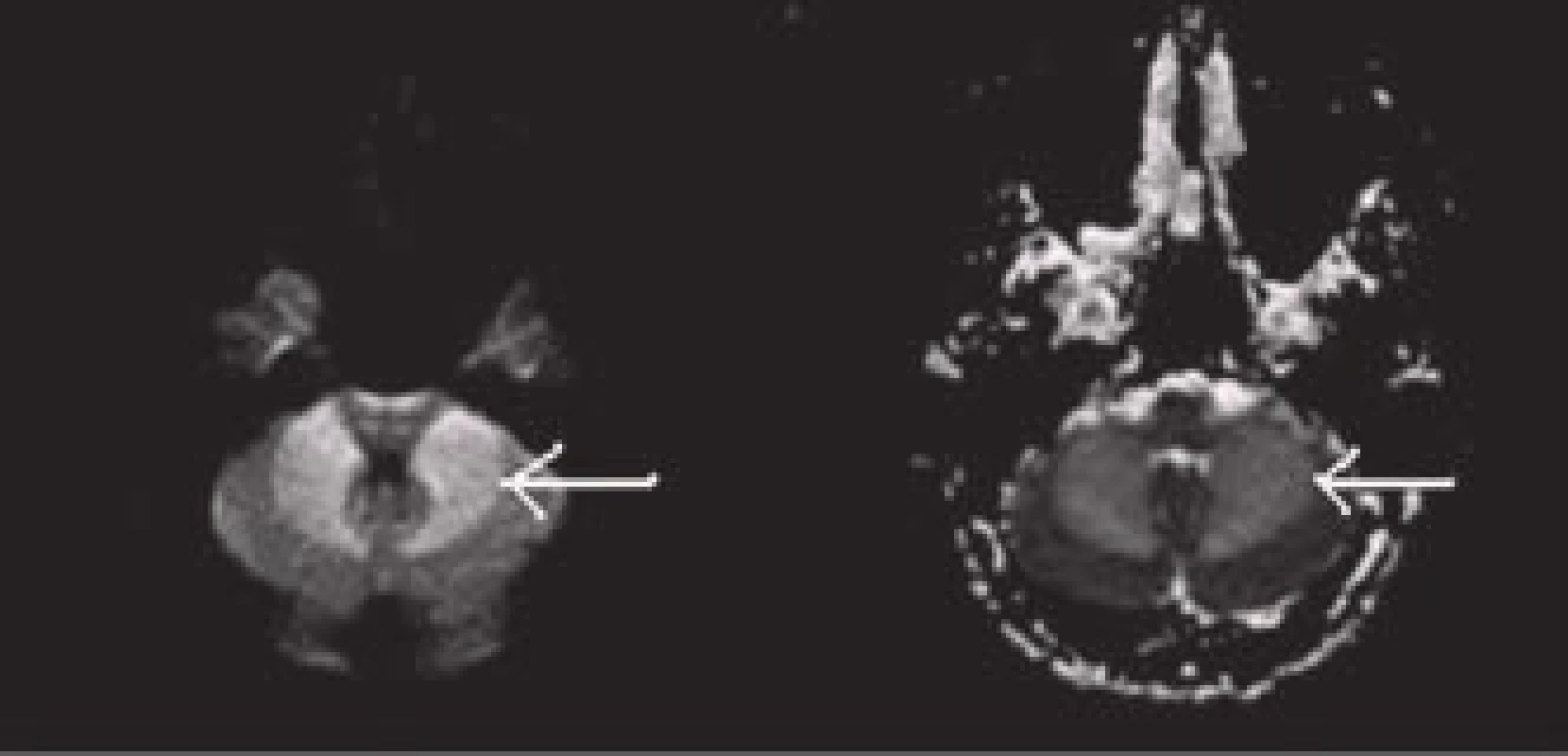
Na druhou stranu lze specificitu zvýšit pořízením tzv. ADC (apparent diffusion coefficient), který se získá softwarovým výpočtem z difuzních hodnot. Hodnoty ADC jsou kódovány ve stupních šedi, což zobrazuje tzv. ADC mapa (obr. 19). Ischemická léze na ADC mapě topicky a rozsahem koreluje s DWI lézí, ale je k ní inverzní co do intenzity (hypointenzita odstupňovaná dle hodnoty ADC koeficientu) a není ovlivněna T2. Tím lze eliminovat „shine-through“ fenomén i falešnou pozitivitu výše zmíněných neischemických příčin hyperintenzity na DWI (při „shine-through“ na ADC mapě není korelující hypointenzita nebo je také hyperintenzita – obr. 20) [40].
Z hlediska managementu akutního mozkového infarktu by ADC mohl pomoci stanovit číselnou hranici tíže difuzní poruchy, která by oddělila ireverzibilně postiženou oblast od reverzibilní. Čím nižší hodnota ADC, tím těžší postižení difuze a tím větší pravděpodobnost rozvoje infarktu. Nicméně dosud nebyla nalezena žádná taková hodnota ADC koeficientu, při níž by se tkáň takto postižená nemohla časnou rekanalizací normalizovat. Senzitivita a specificita MRI (DWI) v detekci akutní ischemie v prvních šesti hodinách od vzniku je 91 %, resp. 95 %, což převyšuje CT zobrazení, kde byly zjištěné hodnoty významně nižší (61 %, resp. 65 %). Navíc má MRI i větší schopnost vyloučit jiné (CMP připomínající) příčiny klinických symptomů [40,41].
Obdobně jako na nativním CT lze někdy pozorovat výše zmíněný dense artery sign, lze i na MRI – GRE sekvencích identifikovat trombus tzv. „blooming artifact“ (obr. 21). CT se jeví senzitivnější k detekci proximálních trombů v ACM povodí, GRE zase k distálněji uloženým krevním sraženinám. Hyperintenzní signál krevní sraženiny bývá přítomen i na FLAIR zobrazeních [42–44].
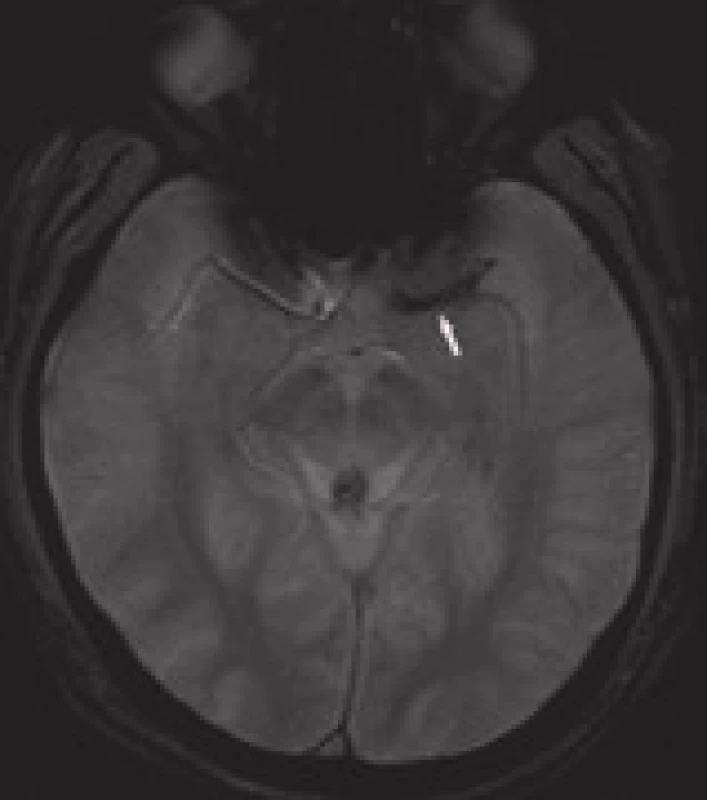
MRI – perfuzně vážené snímky
Perfuzně vážené snímky (PWI) podávají informace o aktuálním prokrvení mozkové tkáně. Po bolusovém podání MR kontrastní látky lze získat stejné parametry jako u CT perfuze (CBV, CBF, MTT, TTP). U MR perfuzních protokolů se zatím nejčastěji používají MTT a TTP parametry. Tkáně s postiženou perfuzí (různě prodlouženy MTT) v sobě opět zahrnuje dokonaný infarkt, penumbru a také oblast benigní oligemie (obdoba CT perfuze – viz výše).
Rozdíl rozsahů perfuzního a difuzního deficitu tedy přibližně určuje velikost penumbry, již lze časnou reperfuzí ještě zachránit, a nazývá se PWI/DWI mismatch (obr. 23). Přesnost tohoto konceptu při určování poměru infarktu a penumbry snižuje jednak přítomnost benigní oligemie jako součásti perfuzního deficitu, jednak schopnost normalizace části difuzního deficitu při časné rekanalizaci tepny [45–47]. Přesto je koncept PWI/DWI mismatche testován pro individualizaci aplikace rekanalizační terapie (viz níže), protože je to v současné době nejpřesnější způsob určení poměru zachranitelné a již nezachranitelné oblasti mozkové tkáně.
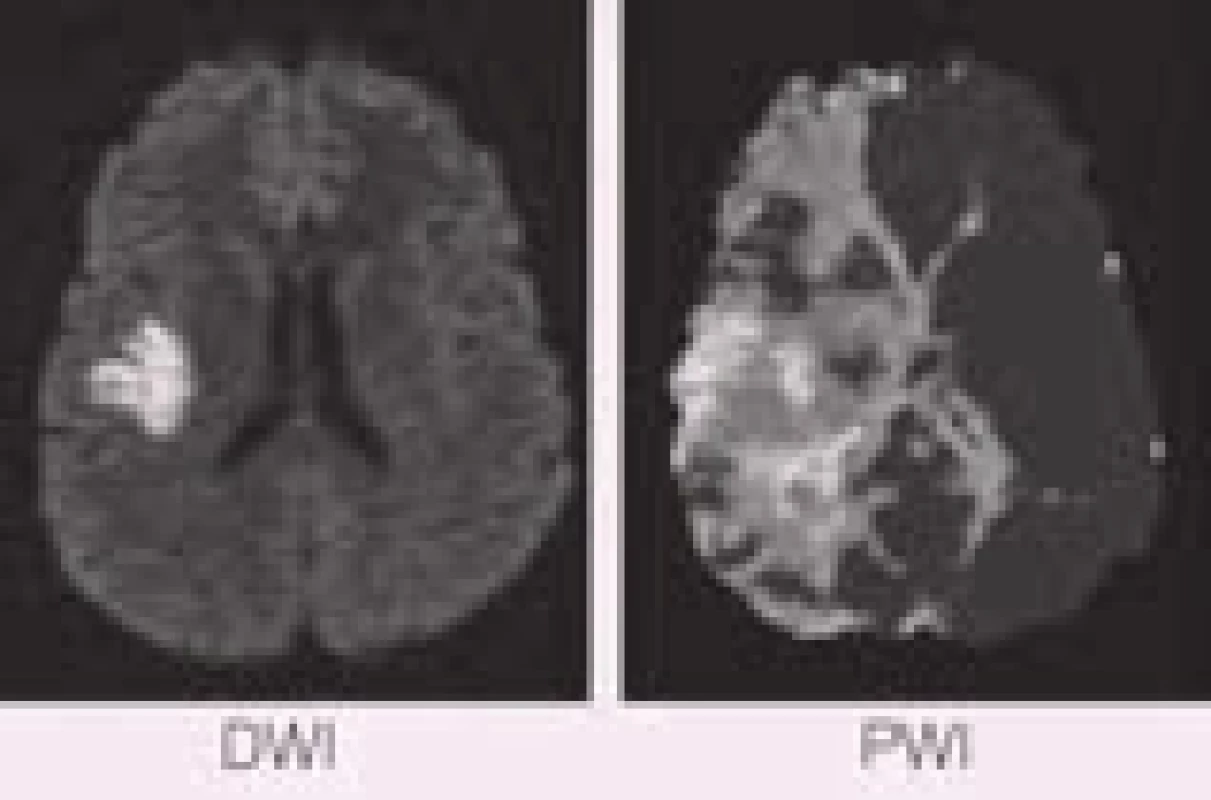
Zajímavé jsou výsledky analýzy pacientů léčených intravenózní trombolýzou, kde byl dobrý klinický stav po třech měsících závislý na velikosti DWI-ADC léze před léčbou (čím menší, tím lepší), nikoli však na velikosti iniciální perfuzní léze. To lze vysvětlit buď dobrým efektem trombolytika, které rekanalizovalo okludované tepny a tím perfuzní léze reperfundovala a penumbra byla zachráněna, nebo také tím, že zobrazené perfuzní léze nepředstavovaly vlastní penumbru, ale třeba jen oblast benigní oligemie, která nekróze nepropadá [49].
Nicméně zjednodušeně platí, že přítomnost PWI/DWI mismatche u pacienta s akutním mozkovým infarktem poukazuje na přetrvávání penumbry, tedy oblasti funkčně postižené, ale časnou reperfuzí zachranitelné. Takový pacient může mít prospěch z rekanalizace tepny bez ohledu na dosud uplynulou dobu od vzniku příznaků. Dle výsledků studií DIAS a DEDAS došlo u pacientů, kteří byli trombolyzováni desmoteplázou mezi 3.–9. hod od vzniku příznaků mozkového infarktu na základě přítomnosti DWI/PWI mismatche, k signifikantně výraznějšímu procentu rekanalizace a příznivého klinického stavu než u pacientů léčených placebem (71,4 % × 19,2 %, resp. 60 % × 22,2 %). Léčba byla rovněž bezpečná stran výskytu symptomatických intracerebrálních krvácení (sICH 2,2 % × 0 %) a efekt léčby neklesal s delším časovým oknem. Ve studiích DEFUSE a EPITHET byl DWI/PWI mismatch prediktorem dobrého klinického stavu při léčbě intravenózní trombolýzou (Actilyse). Naopak pacienti bez mismatche z léčby neprofitovali. Koncept, že PWI léze přibližně ukazuje rozsah penumbry, podporuje i fakt, že u pacientů, kteří rekanalizační terapii nepodstoupí, koreluje konečná velikost infarktu s původní PWI lézí signifikantně více než u pacientů, kteří rekanalizační léčbu podstoupili. Individualizace podání rekanalizační terapie dle konceptu DWI/PWI mismatche směřuje ke zvýšení efektivity tohoto léčebného postupu a současně i k rozšíření počtu vhodných pacientů [40,47,48].
MR angiografie
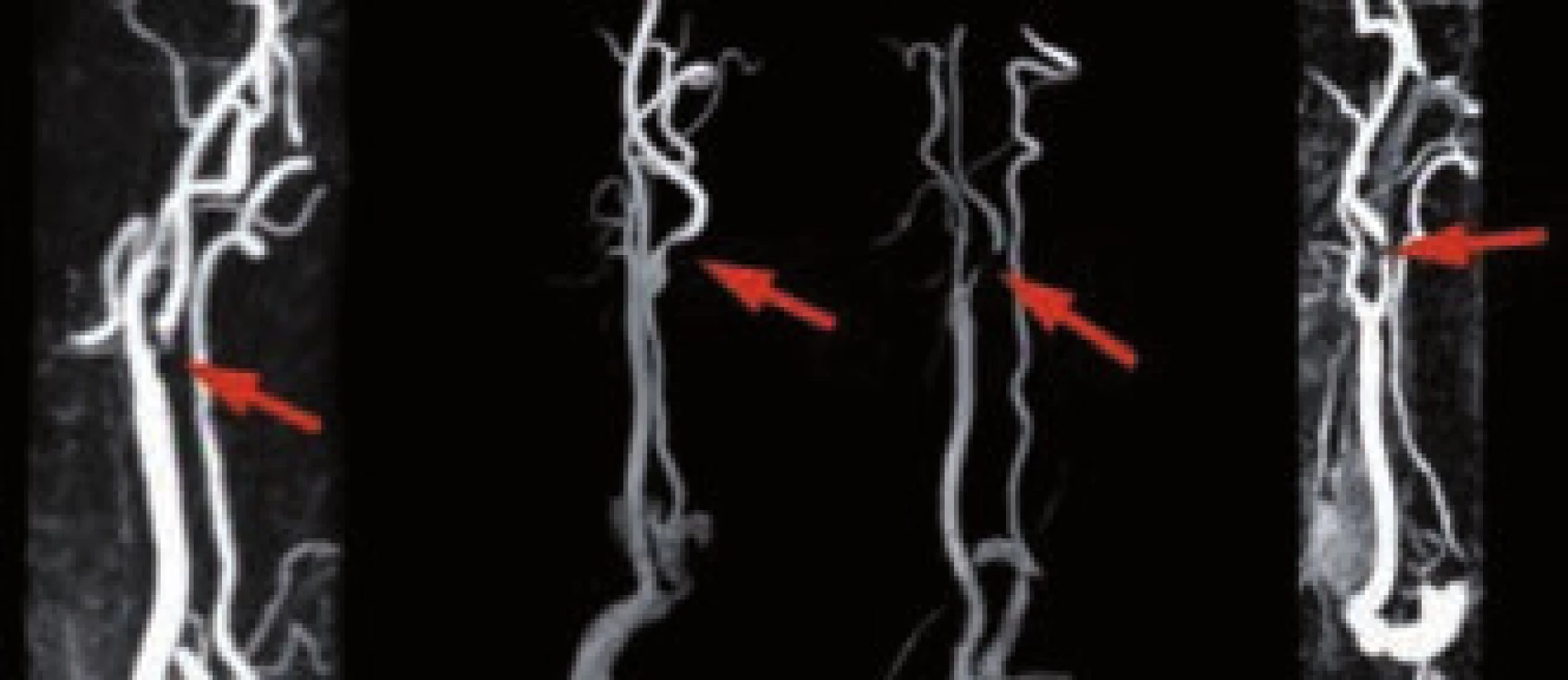
Také při MR vyšetření lze zobrazit jak arteriální, tak venózní řečiště, a lokalizovat tak stenózu či uzávěr tepny. MR angiografii je možno provést nativně (použitím dvou - či třídimenzionálního TOF – time of flight – zobrazení) nebo za pomoci podání nejodové paramagnetické kontrastní látky – gadolinia (kontrastní MR angiografie – CE-MRA). CE-MRA se ukazuje být přesnější než bezkontrastní MRA, a to zejména v zobrazení extrakraniálního řečiště, kdy se jeho senzitivita/specificita uvádí až 97 % (oproti DSA s či bez UZ), tedy s podobnou přesností jako CT angiografie (obr. 26). MRA-TOF je výrazně ovlivnitelná rychlostí toku a turbulencemi, což vede k nadhodnocování tíže stenózy a k artefaktům zejm. při zobrazení stenóz nad 70 %. I když se publikované senzitivity/specificity obou MRA postupů pohybují nejčastěji mezi 85–95 % [50–53], praktické zkušenosti autorů hovoří spíše pro větší přesnost CT angiografie a to z důvodů její větší výpovědní hodnoty zejm. u filiformních a na UZ špatně hodnotitelných stenóz a také pro nadhodnocování stenózy i u CE-MRA. Senzitivita a specificita intrakraniální MR angiografie (TOF) se pohybuje kolem 60–85 % pro stenózu a 80–90 % pro okluzi tepny ve srovnání s CTAG či DSA (obr. 24) [54–56]. Studie SONIA ukázala, že MRA má dostačující negativní prediktivní hodnotu, nicméně v případě, že se na intrakraniální MRA jeví patologie, je nutné doplnit další z angiografických zobrazení (CT angiografie, DSA).

Neurosonologické vyšetření
V současné době, kdy je možnost provádění CT (či MR) angiografického vyšetření standardem na většině pracovišť zajišťujících péči o akutní cévní mozkové příhody, by se mohlo jevit UZ vyšetření jako nadbytečné. Opak je často pravdou, neboť může ošetřujícímu lékaři podat velmi důležité informace, které z vyšetření CT či MRI nezíská a které mohou být navíc v čase neustále aktualizovány díky „bedside“ neinvazivnímu charakteru vyšetření. Zejména se jedná o charakteristiky průtokové křivky (tvar, rychlost, směr). Dle těchto parametrů pak lze posuzovat např. vydatnost a typ kolaterálního oběhu, hemodynamický dopad recentní obstrukce v cévním řečišti, efekt aplikované terapie a tím udávat další směr terapeutického postupu. V akutní fázi se používá jak extrakraniální ultrazvukové vyšetření, tak zejména transkraniální UZ vyšetření.
Extrakraniální UZ vyšetření
K vyšetření krčních tepen zásobujících mozek se používá UZ vyšetření kombinující tzv. B-mode a barevně kódovaný pulzní Doppler. B-mode ultrazvukového vyšetření podává jednak morfologické informace o vyšetřovaném cévním řečišti a jednak slouží jako podklad k zacílení vzorkovacího objemu při dopplerovském vyšetření. Barevné kódování je určováno dle směru toku a rychlostí toku.
Takto vyšetřujeme jak karotické řečiště (arteria carotis communis – ACC, arteria carotis interna – ACI, arteria carotis externa – ACE), tak rovněž krční úsek vertebrobazilárního povodí (vertebrální tepny – AV či část a. subclavia – ASCL). Hodnotí se jednak přímé známky obstrukce tepny (dle morfologie nalezených změn, dle charakteristik toku v oblasti obstrukce), jednak tzv. nepřímé známky, což jsou průtokové abnormality zachycené v jiných oblastech cévního řečiště, než v jakých se vlastní obstrukce vyskytuje, ale které jsou touto obstrukcí vyvolány.
Mezi přímé známky patří např. nález AS plátů (možná další stratifikace dle Gray--Weale et al [62]), kalcifikací, trombů, disekce cévní stěny, akcelerovaný a turbulentní tok v oblasti významné stenózy či nepřítomnost toku v okluzi. Nepřímými známkami jsou např. obrácený tok jako projev steal syndromu či kolaterálního oběhu, alterace toků v prestenotickém a poststenotickém úseku tepny, tzv. flowdiversion (viz níže) aj. [57,58].
Obstrukční postižení karotid se na základě morfologie a dopplerovského vyšetření stratifikuje na stenózy do 50 % (event. do 30 % a 30–50 %), 50–70 %, 70–99 % a okluzi [59]. Dle doporučení by se procentuální redukce průměru karotidy měla vztahovat relativně k distálnímu úseku tepny stenózou nepostiženého (kritéria NASCET) [40]. V určení stenózy dle dopplerovského měření se využívají zejména maximální systolická rychlost (peak systolic velocity – PSV), diastolická rychlost (end-diastolic velocity – EDV) a vzájemný poměr PSV (event. EDV) ve stenóze a PSV (event. EDV) v arteria carotis communis (ACC). Existuje více dopplerovských kritérií pro stratifikaci stenózy (viz tab. 2 a 3), z nichž autoři považují za nejpříhodnější ty dle Carpentera.
![Stanoven tíže stenózy dle Carpentera et al [60].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/efc8122fe3f2197028758baf05dd6b45.png)
![Stanovení tíže podle Fausta et al [59].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/bdfb7ccf43c220ba0142de6873b2c5e1.png)
Metaanalýza jednotlivých srovnávacích studií (UZ × DSA, UZ vs CT angiografie či MR angiografie) ukazuje specificitu UZ vyšetření vyšší než 80 % a specificitu nad 90 % [61]. Nicméně se doporučuje, aby každá laboratoř provedla vlastní validaci, kdy přesnost měření závisí nejen na parametrech přístroje a technickém vybavení, ale rovněž na zkušenostech vyšetřujícího. Největší senzitivitu a specificitu k určení stenózy má kombinované vyšetření (UZ + MRA či CTA) [40].
Transkraniální UZ vyšetření
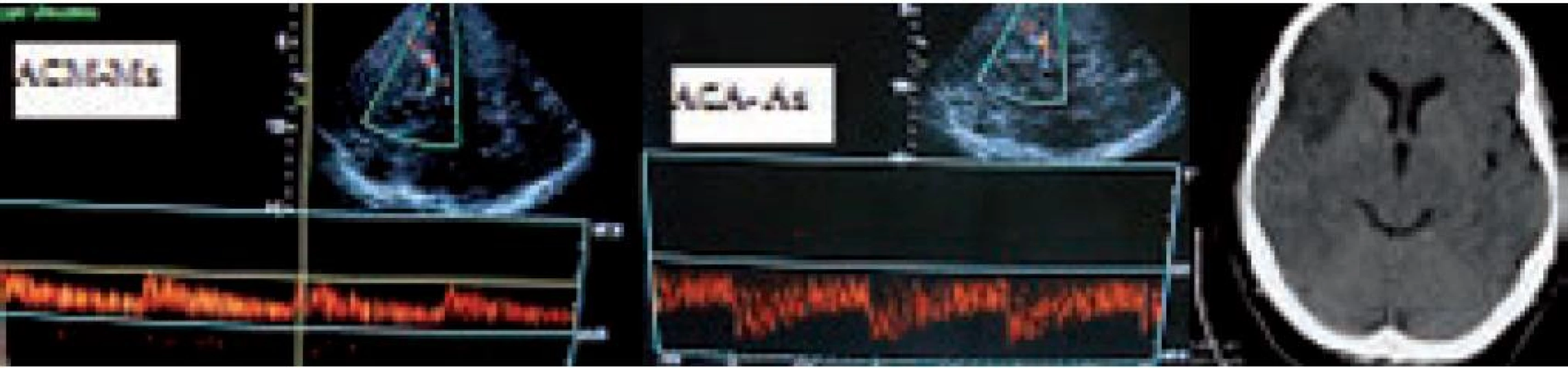
K vyšetření intrakraniálních tepen se používá tzv. TCD – transkraniální doppler, event. (na českých pracovištích oblíbené) TCCS (transkraniální barevně kódovaná sonografie), která kombinuje barevně kódovaný doppler (TCCD) a B-mode (obr. 25). Oproti TCD má výhody zejména v lepší možnosti zacílení do konkrétních tepen a jejich segmentů – v přední (a. cerebri media vč. M2 úseků, a. cerebri anterior, terminální ACI, přední komunikanta, a. ophtalmica) a zadní cirkulaci (a. cerebri posterior, zadní komunikanta, a. basilaris a terminální úseky vertebrálních tepen). Dále umožňuje úhlovou korekci, která vede k přesnějšímu měření rychlostí toku. Přítomnost B-modu vizualizuje některé mozkové struktury a tím lze např. orientačně posoudit, event. posun třetí komory při maligním edému, či detekovat některé intrakraniální hemoragie [63].
Cílem TCCS (resp. TCD) v akutní fázi CMP je identifikovat okluzi či stenózu intrakraniální tepny a pak, a to zejména, mít možnost monitorace této tepny v čase. Tento fakt je největším přínosem tohoto neinvazivního bedside vyšetření a umožňuje libovolně častou kontrolu stavu tepny v průběhu akutní terapie (zejména intravenózní trombolýzy) a na základě nálezu pak často umožňuje rozhodovat o dalším managementu terapeutického postupu (hlavně stran indikace intervenčních postupů).
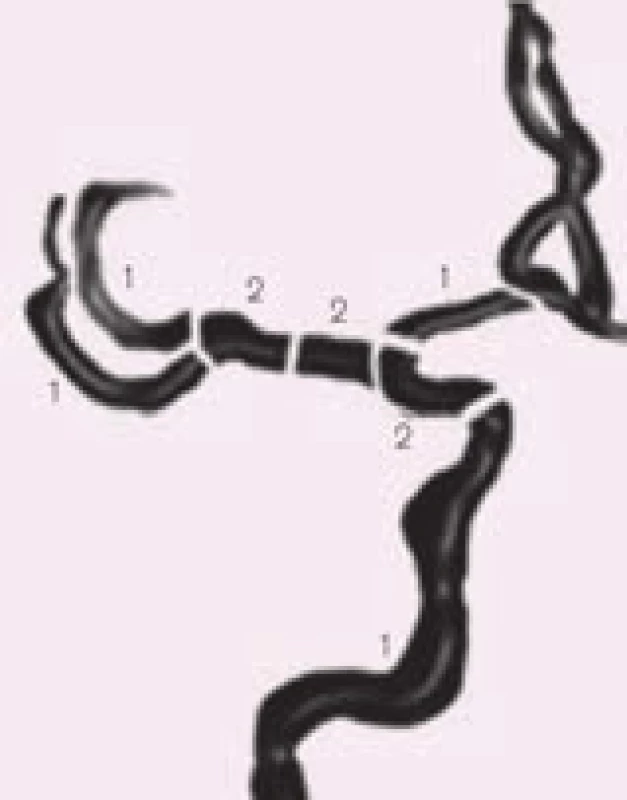
Mezi hlavní kritéria používaná v hodnocení stavu intrakraniálního tepenného řečiště u akutního mozkového infarktu patří tzv. TIBI kritéria (Thrombolysis In Brain Ischemia). Byla ustanovena dle TCD vyšetření, tedy bez úhlové korekce [64] (obr. 26). Popisují stav tepen ve smyslu okluze a rekanalizace, přičemž okluzi představují TIBI 0–3. Známkou rekanalizace je TIBI 4 a 5, kdy se jedná o plnou rekanalizaci. Při parciální rekanalizaci dochází ke zlepšení o 1 a více TIBI stupňů, ale ne na 4–5. Naopak při reokluzi dojde ke zhoršení o 1 a více stupňů.
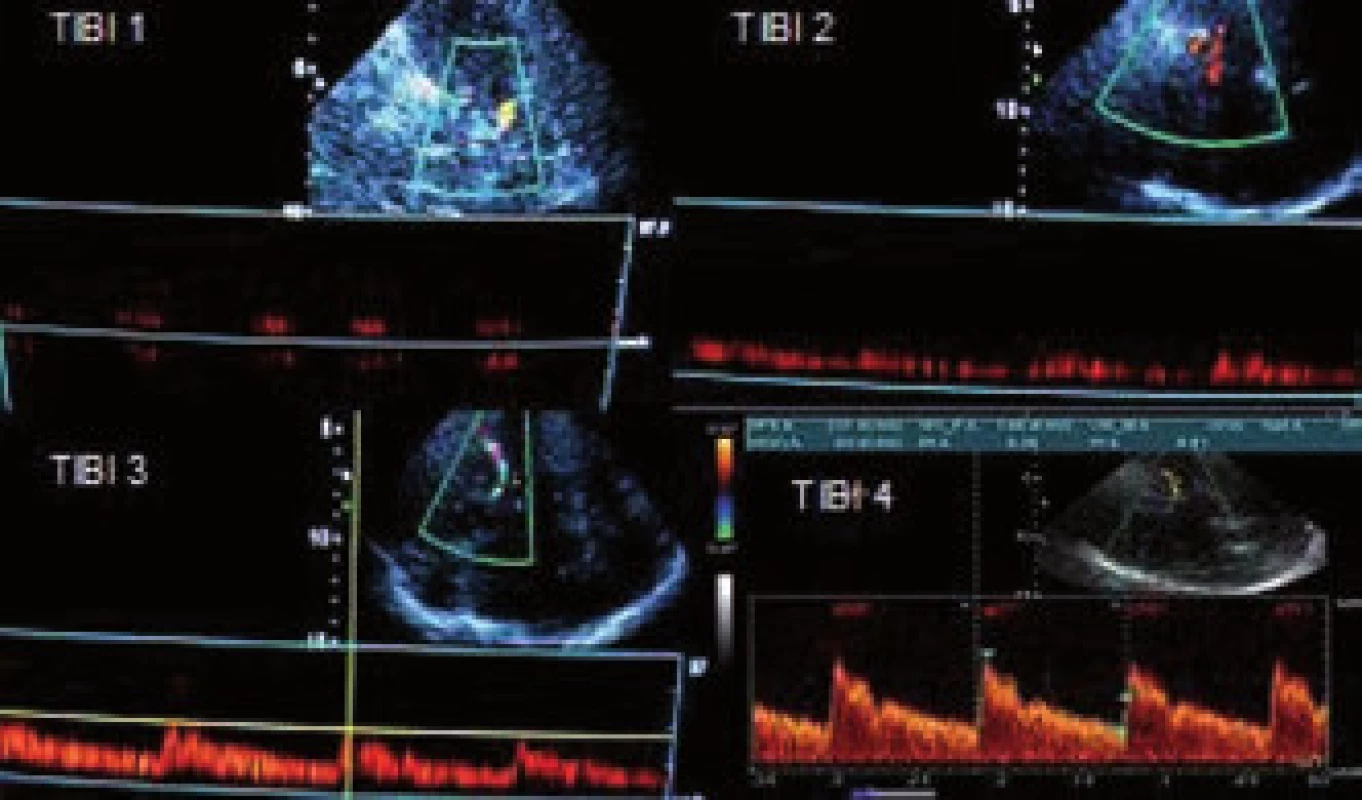
TIBI klasifikace a její změna u akutního mozkového infarktu koreluje s tíží klinického stavu a jeho vývojem v čase u pacientů léčených intravenózní trombolýzou [68].
Senzitivita a specificita TCD vyšetření ve stanovení intrakraniální stenózy je v přední cirkulaci vyšší než v cirkulaci zadní a dle různých prací se pohybuje mezi 70–90 %, resp. 90–95 % [40].
Některé práce stanovují kritéria pro určení stenózy a okluze ACM M1 úseku dle rychlostí toku po úhlové korekci. U stenóz nad 50 % je PSV (peak systolic velocity) nad 140 cm/s (senzitivita 83,3 %; specificita 91,2 %) a u okluze EDV (end-diastolic velocity) pod 26 cm/s, a to současně při relativním snížení této rychlosti oproti zdravé straně více než 2,5krát [65,66].
Nutno však zdůraznit, že pouze tato kritéria nejsou, dle názoru autorů, dostačující. Mezi další pomocné parametry patří např. nález kolaterálního toku, obráceného toku či tzv. flowdiversion (akcelerace toků v jedné z tepenných větví při okluzi v povodí větve jiné – obr. 27). Celkové zhodnocení (a tedy i přesnost vyšetření) je ovlivňováno mnoha dalšími okolnostmi, počínaje typem ultrazvukového přístroje, přes další výše zmíněné charakteristiky toku, B obrazu a jiné přídatné okolnosti (např. vícečetné stenotické či okluzivní onemocnění tepen ovlivňující UZ zachycené parametry, kardiální onemocnění apod.) až po zkušenost a zručnost vyšetřujícího.
Využití transkraniálního UZ vyšetření je také limitované absencí tzv. kostního okna u cca 10 % pacientů, kdy nelze přes temporální kost tepny zobrazit. V mnoha případech lze tuto nevýhodu odstranit podáním ultrazvukové kontrastní látky. Podání kontrastní látky také zlepšuje specificitu a senzitivitu vyšetření, i když ta bude i tak v detekci stenookluzivního postižení stále nižší než u CT angiografického vyšetření (u multidetektorových přístrojů) [40]. V případě nutnosti srovnání rychlostí při TCD, resp. TCCD v čase (např. při posuzování rekanalizace) je pak vhodné i další vyšetření provádět po podání kontrastní látky, protože tato může zvyšovat absolutní rychlosti toků o 10–20 % [63].
Stejně jako u extrakraniálního zobrazení je doporučováno, aby každá UZ laboratoř provedla lokální validaci přesnosti svého vyšetření.
Tranzitorní ischemická ataka a její diagnostika
Před závěrečným shrnutím se autoři domnívají, že je nutné zmínit velmi důležitý fakt, týkající se přechodných ischemických atak neboli příznaků CMP, které po krátkém trvání odezněly. K problematice tranzitorní ischemické ataky (TIA) je nutno přistupovat velmi zodpovědně, protože se jedná o závažnou diagnózu s vysokým rizikem recidivy v podobě dokonané CMP. V případech TIA je plně indikováno akutní došetření v podobě zobrazovacích vyšetření a to zejména MRI, kdy se ukazuje, že až 1/3 pacientů s TIA má následně lézi na DWI [67]. Rovněž je důležité provedení akutního zobrazení tepen ať již CTAG, MRAG či UZ. Část pacientů s TIA má uzavřenou či významně stenotickou některou z tepen a hrozí časná závažná recidiva.
Rovněž platí doplnění dalších vyšetření a preventivních opatření v rámci standardní péče o CMP.
Závěr
Diagnostický postup u akutní CMP je komplexem především výše zmíněných vyšetření, které mají za úkol nejen určit typ CMP, ale rovněž podat dostatečně obsáhlé informace vedoucí ke zvolení terapie s co nejlepším poměrem benefit/riziko. Na základě získaných dat se klinik rozhoduje o volbě, typu, časování a posloupnosti terapeutických postupů, odhaduje prognózu.
Je nutno ctít známé „time is brain“, a tedy jednat účinně a bez zbytečných prodlení. V tomto směru se jeví jako výhodný standardní vyšetřovací protokol, který pacient s podezřením na CMP automaticky v rámci diagnostiky podstoupí. Nicméně, i když na jednu stranu je často užitečné provést co nejvíce možných vyšetření, na druhou stranu není možné jimi ztrácet čas. Proto detailní znalost a potenciální výtěžnost výše zmíněných paraklinických vyšetření umožní lepší klinicko-radiologický management šitý na míru konkrétní situaci. Jen tak je možno dosáhnout rychlé a precizní diagnostiky vedoucí k optimální možné terapii s co nejlepším možným výsledkem.
Zdroje podpory formou grantů, přístrojového vybavení nebo léků: M. Reif, D. Goldemund a R. Mikulík jsou podporováni z Evropského fondu regionálního rozvoje – Projekt FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
Doručeno do redakce 17. 1. 2013
Přijato po recenzi 7. 2. 2013
MUDr. Michal Reif
MUDr. David Goldemund
doc. MUDr. Robert Mikulík, Ph.D.
Mezinárodní centrum klinického výzkumu (ICRC) a Neurologická klinika FN u sv. Anny v Brně
michal.reif@fnusa.cz
Zdroje
1. Hurley MC, Soltanolkotabi M, Ansari S. Neuroimaging in acute stroke: choosing the right patient for neurointervention.Tech Vasc Interv Radiol 2012; 15 : 19–32.
2. Meyer BC, Hemmen TM, Jackson CM et al. Modified National Institutes of Health stroke scale for use in strokeclinical trials: prospective reliability and validity. Stroke 2002; 33 : 1261–1266.
3. Mikulik R, Ribo M, Hill MD et al. CLOTBUST Investigators. Accuracy of serial National Institutes of Health Stroke Scale scores to identify artery status in acute ischemic stroke. Circulation 2007; 115 : 2660–2665.
4. Weimar C, König IR, Kraywinkel K et al. Age and National Institutes of Health Stroke Scale score Within 6 Hours After Onset Are Accurate Predictors of Outcome After Cerebral Ischemia: Development and External Validation of Prognostic Models. Stroke 2004; 35 : 158–162.
5. Ezzeddine MA, Lev MH, McDonald CT et al. CT angiography with whole brain perfused blood volume imaging: added clinical value in the assessment of acute stroke. Stroke 2002; 33 : 959–966.
6. Smith EE, Rosand J, Greenberg SM. Imaging of Hemorrhagic Stroke. Magn Reson Imaging Clin N Am 2006; 14 : 127–140.
7. Bergström M, Ericson K, Levander B et al. Variation with time of the attenuation values of intracranial hematomas. J Comput Assist Tomogr 1977; 1 : 57–63.
8. Selariu E, Zia E, Brizzi M et al. Swirl sign in intracerebral haemorrhage: definition, prevalence, reliability and prognostic value. BMC Neurology 2012, 12 : 109.
9. Broderick JP, Brott TG, Duldner JE et al. Volume of intracerebral hemorrhage. A powerful and easy-to--use predictor of 30-daymortality. Stroke 1993; 24 : 987–993.
10. Demchuk AM, Dowlatshahi D, Rodriguez-Luna D et al. PREDICT/Sunnybrook ICH CTA study group. Prediction of haematoma growth and outcome in patients with intracerebral haemorrhage using the CT--angiography spot sign (PREDICT): a prospective observational study. Lancet Neurol 2012; 11 : 307–314.
11. Kidwell CS, Chalela JA, Saver JL et al. Comparison of MRI and CT for detection of acute intracerebral hemorrhage. JAMA 2004; 292 : 1823–1830.
12. Boulanger JM, Coutts SB, Eliasziw M et al. VISION Study Group. Cerebral microhemorrhages predict new disabling or fatal strokes in patients with acute ischemic stroke or transient ischemic attack. Stroke 2006; 37 : 911–914.
13. Kucinski T. Unenhanced CT and acute stroke physiology. Neuroimaging Clin N Am 2005; 15 : 397–407, xi–xii.
14. Wardlaw JM, Mielke O. Early Signs of brain infarction at CT: observer reliability and outcome after thrombolytic treatment – systematic review. Radiology 2005; 235 : 444–453.
15. Lev MH, Farkas J, Gemmete JJ et al. Acute stroke: improved nonenhanced CT detection –benefits of soft-copy interpretation by using variable window width and center level settings. Radiology 1999; 213 : 150–155.
16. Derex L, Hermier M, Adeleine P et al. Clinical and imaging predictors of intracerebral haemorrhage in stroke patients treated with intravenous tissue plasminogen activator. J Neurol Neurosurg Psychiatry 2005; 76 : 70–75.
17. von Kummer R, Allen KL, Holle R et al. Acute stroke: usefulness of early CT findings before thrombolytic therapy. Radiology 1997; 205 : 327–333.
18. Barber PA, Demchuk AM, Zhang J et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score. Lancet 2000; 355 : 1670–1674.
19. Hill MD, Rowley HA, Adler F et al. PROACT-II Investigators. Selection of acute ischemic stroke patients for intra-arterial thrombolysis with pro-urokinase by using ASPECTS. Stroke 2003; 34 : 1925–1931.
20. Sillanpaa N, Rusanen H, Saarinen JT et al. Comparison of 64-row and 16-row multidetector CT in the perfusion CT evaluation of acute ischemic stroke patients receiving intravenous thrombolytic therapy. Neuroradiology 2012; 54 : 957–963.
21. Puig J, Pedraza S, Demchuk A et al. Quantification of thrombus hounsfield units on noncontrast CT predictsstroke subtype and early recanalization after intravenous recombinant tissue plasminogen activator. AJNR Am J Neuroradiol 2012; 33 : 90–60.
22. Riedel CH, Zimmermann P, Jensen-Kondering U et al. The importance of size: successful recanalization by intravenous thrombolysis in acute anterior stroke depends on thrombus length. Stroke 2011; 42 : 1775–1777.
23. Kim EY, Heo JH, Lee SK et al. Prediction of thrombolytic efficacy in acute ischemic stroke using thin section noncontrast CT. Neurology 2006; 67 : 1846–1848.
24. Lev MH, Segal AZ, Farkas J et al. Utility of perfusion-weighted CT imaging in acute middle cerebral artery stroke treated with intra-arterial thrombolysis: prediction of final infarct volume and clinical outcome. Stroke 2001; 32 : 2021–2028.
25. Wintermark M, Reichhart M, Thiran JP et al. Prognostic accuracy of cerebral blood flow measurement by perfusion computed tomography, at the time of emergency room admission, in acute stroke patients. Ann Neurol 2002; 51 : 417–432.
26. Kidwell CS, Alger JR, Saver JL. Beyond mismatch: evolving paradigms in imaging the ischemic penumbra with multimodal magnetic resonance imaging. Stroke 2003; 34 : 2729–2735.
27. Wintermark M, Flanders AE, Velthuis B et al. Perfusion-CT assessment of infarct core and penumbra: receiver operating characteristic curve analysis in 130 patients suspected of acute hemispheric stroke. Stroke 2006; 37 : 979–985.
28. Wintermark M, Meuli R, Browaeys P et al. Comparison of CT perfusion and angiography and MRI in selecting stroke patients for acute treatment. Neurology 2007; 68 : 694–697.
29. Adams HP Jr, del Zoppo G, Alberts MJ et al. Guidelines for the early management of adults with ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Circulation 2007; 115: e478–e534.
30. Calamante F, Willats L, Gadian DG et al. Bolus delay and dispersion in perfusion MRI: implications for tissue predictor models in stroke. Magn Reson Med 2006; 55 : 1180–1185.
31. Lev MH, Farkas J, Rodriguez VR et al. CT angiography in the rapid triage of patients with hyperacute stroke to intraarterial thrombolysis: accuracy in the detection of large vessel thrombus. J Comput Assist Tomogr 2001; 25 : 520–528.
32. Lehmann KJ, Neff KW, Ries S et al. Spiral CT angiography in stenoses of the middle cerebral artery. Radiologe 1996; 36 : 845–849.
33. Tan IY, Demchuk AM, Hopyan J et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. AJNR Am J Neuroradiol 2009; 30; 525–531.
34. Puetz V, Dzialowski I, Hill MD et al. Calgary CTA Study Group. Intracranial thrombus extent predicts clinical outcome, final infarct size and hemorrhagic transformation in ischemic stroke: the clot burden score. Int J Stroke 2008; 3 : 230–236.
35. Miteff F, Levi CR, Bateman GA et al. The independent predictive utility of computed tomography angiographic collateral status in acute ischaemic stroke. Brain 2009; 132(Pt 8): 2231–2238.
36. Bryan RN, Levy LM, Whitlow WD et al. Diagnosis of acute cerebral infarction: comparison of CT and MR imaging. AJNR Am J Neuroradiol 1991; 12 : 611–620.
37. Albers GW, Lansberg MG, Norbash AM et al. Yield of diffusion-weighted MRI for detection of potentially relevant findings in stroke patients. Neurology 2000; 54 : 1562–1567.
38. Wiener JI, King JT Jr, Moore JR et al. The value of diffusion-weighted imaging for prediction of lasting deficit in acute stroke: an analysis of 134 patients with acute neurologic deficits. Neuroradiology 2001; 43 : 435–441.
39. Kidwell CS, Saver JL, Mattiello J et al. Thrombolytic reversal of acute human cerebral ischemic injury shown by diffusion/perfusion magnetic resonance imaging. Ann Neurol 2000; 47 : 462–469.
40. Latchaw RE et al. Recommendation for paging of acute ischemic stroke: a scientific statement from the AHA. Stroke 2009; 3646–3678.
41. Fiebach JB, Schellinger PD, Jansen O et al. CT and diffusion-weighted MR imaging in randomized order: diffusion-weighted imaging results in higher accuracy and lower interrater variability in the diagnosis of hyperacute ischemic stroke. Stroke 2002; 33 : 2206–2210.
42. Flacke S, Urbach H, Keller E et al. Middle cerebral artery (MCA) susceptibility sign at susceptibility-based erfusion MR imaging: clinical importance and comparison with hyperdense MCA sign at CT. Radiology 2000; 215 : 476–482.
43. Liebeskind DS, Sanossian N, Yong WH et al. CT and MRI early vessel signs reflect clot composition in acute stroke. Stroke 2011; 42 : 1237–1243.
44. Assouline E, Benziane K, Reizine D et al. Intra-arterial thrombus visualized on T2* gradient echo imaging in acute ischemic stroke. Cerebrovasc Dis 2005; 20 : 6–11.
45. Schaefer PW, Ozsunar Y, He J et al. Assessing tissue viability with MR diffusion and perfusion imaging. AJNR Am J Neuroradiol 2003; 24 : 436–443.
46. Butcher K, Parsons M, Baird T et al. Perfusion thresholds in acute stroke thrombolysis. Stroke 2003; 34 : 2159–2164.
47. Ogata T, Christensen S, Nagakane Y et al. EPITHET and DEFUSE Investigators. The effects of alteplase 3 to 6 hours after stroke in the EPITHET–DEFUSE combined dataset: post hoc case-control study. Stroke 2013; 44 : 87–93.
48. Albers GW, Thijs VN, Wechsler L et al. Magnetic resonance imaging profiles predict clinical response to early reperfusion: The diffusion and perfusion imaging evaluation for understanding stroke evolution (DEFUSE). Study Ann Neurol 2006; 60 : 508–517.
49. Ogata T, Nagakane Y, Christensen S et al. EPITHET and DEFUSE Investigators. A topographic study of the evolution of the MR DWI/PWI mismatch pattern and its clinical impact: A study by the EPITHET and DEFUSE onvestigators. Stroke 2011; 42 : 1596–1601.
50. Okumura A, Araki Y, Nishimura Y et al. The clinical utility of contrast-enhanced 3D MR angiogramy for cerebrovascular disease. Neurol Res 2001; 23 : 767–771.
51. Nederkoorn PJ, Elgersma OE, van der Graaf Y et al. Carotid artery stenosis: accuracy of contrastenhanced MR angiography for diagnosis. Radiology 2003; 228 : 677–682.
52. Remonda L, Heid O, Schroth G. Carotid artery stenosis, occlusion, and pseudo-occlusion: first-pass, gadolinium-enhanced, three-dimensional MR angiography – preliminary study. Radiology 1998; 209 : 95–102.
53. Goyal M, Nicol J, Gandhi D. Evaluation of carotid artery stenosis: contrast-enhanced magnetic resonance angiography compared with conventional digital subtraction angiography. Can Assoc Radiol J 2004; 55 : 111–119.
54. Bash S, Villablanca JP, Jahan R et al. Intracranial vascular stenosis and occlusive disease: evaluation with CT angiography, MR angiography, and digital subtraction angiography. AJNR Am J Neuroradiol 2005; 26 : 1012–1021.
55. Hirai T, Korogi Y, Ono K et al. Prospective evaluation of suspected stenoocclusive disease of the intracranial artery: combined MR angiography and CT angiography compared with digital subtraction angiography. AJNR Am J Neuroradiol 2002; 23 : 93–101.
56. Stroke Outcomes and Neuroimaging of Intracranial Atherosclerosis (SONIA) Trial Investigators. Stroke Outcome and Neuroimaging of Intracranial Atherosclerosis (SONIA): design of a prospective, multicenter trial of diagnostic tests. Neuroepidemiology 2004; 23 : 23–32.
57. Thiele BL, Jones AM, Hobson RW et al. Standards in noninvasive cerebrovascular testing: report from the Committee on Standards for Noninvasive Vascular Testing of the Joint Council of the Society for Vascular Surgery and the North American Chapter of the International Society for Cardiovascular Surgery. J Vasc Surg 1992; 15 : 495–503.
58. Alexandrov AV, Brodie DS, McLean A et al. Correlation of peak systolic velocity and angiographic measurement of carotid stenosis revisited. Stroke 1997; 28 : 339–342
59. Faught WE, Mattos MA, van Bemmelen PS et al. Color-flow duplex scanning of carotid arteries: new velocity criteria based on receiver operator characteristic analysis for threshold stenoses used in the symptomatic and asymptomatic carotid trials. J Vasc Surg 1994; 19 : 818–827.
60. Carpenter JP, Lexa FJ, Davis JT. Determination of sixty percent or greater carotid artery stenosis by duplex Doppler ultrasonography. J Vasc Surg 1995; 22 : 697–703.
61. Long A, Lepoutre A, Corbillon E et al. Critical review of non - or minimally invasive methods (duplex ultrasonography, MR - and CT-angiography) for evaluating stenosis of the proximal internal karotid artery. Eur J Vasc Endovasc Surg 2002; 24 : 43–52.
62. Gray-Weale AC, Graham JC, Burnett JR et al. Carotid artery atheroma: comparison of preoperative B-mode ultrasound appearance with carotid endarterectomy specimen pathology. J Cardiovasc Surg (Torino) 1988; 29 : 676–681.
63. Nedelmann M, Stolz E, Gerriets T et al. TCCS Consensus Group. Consensus recommendations for transcranial color-coded duplex sonography for the assessment of intracranial arteries in clinical trials on acute stroke. Stroke 2009; 40 : 3238–3244.
64. Burgin WS, Malkoff M, Felberg RA et al. Transcranial doppler ultrasound criteria for recanalization after thrombolysis for middle cerebral artery stroke. Stroke 2000; 31 : 1128–1132.
65. Tang SC, Jeng JS, Yip PK et al. Transcranial color-coded sonography for the detection of middle cerebral artery stenosis. J Ultrasound Med 2005; 24 : 451–457; quiz 459–460.
66. Ogata T, Kimura K, Nakajima M et al. Diagnosis of middle cerebral artery occlusive lesions with contrast-enhanced transcranial color-coded real-time sonography in acute stroke. Neuroradiology 2005; 47 : 256–262.
67. Kidwell CS, Alger JR, Di Salle F et al. Diffusion MRI in patients with transient ischemic attacks. Stroke 1999; 30 : 1174–1180.
68. Demchuk AM, Burgin WS, Christou I et al. Thrombolysis in brain ischemia (TIBI) transcranial Doppler flow grades predict clinical severity, early recovery, and mortality in patients treated with intravenous tissue plasminogen activator Stroke 2001; 32 : 89–93.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2013 Číslo 1
Nejčtenější v tomto čísle
- Nejdůležitější metody v diagnostice akutní cévní mozkové příhody
- Terapie akutní ischemické cévní mozkové příhody
- Primární a sekundární prevence ischemických cévních mozkových příhod
- Arytmie a cévní mozková příhoda