Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
Overview of echocardiographic parameters in the diagnostics of heart failure with preserved ejection fraction of the left ventricle
Heart failure with preserved ejection fraction occurs almost with the same frequency and severity as heart failure with reduced ejection fraction. Echocardiography is the most useful non-invasive diagnostic test in the evaluation of this condition. However, no single parameter that would allow a simple assessment of the diastolic function has been discovered yet. For an accurate diagnosis, a complex echocardiographic examination must be performed to demonstrate the presence of structural and/ or functional cardiac abnormalities. Structural parameters, determinants of transmitral and pulmonary venous flow velocity by pulse Doppler, and mitral annular velocity by tissue Doppler, are used to make this assessment. Also speckle tracking echocardiography and an evaluation of myocardial deformity are becoming part of an integrated approach to the assessment of diastolic function. Many other parameters are the subject of extensive clinical research.
Key words:
heart failure with preserved ejection fraction – diastolic dysfunction – echocardiography
Autoři:
M. Špinarová 1; J. Meluzín 1,2; L. Špinarová 1
Působiště autorů:
I. interní kardioangiologická klinika LF MU a FN u sv. Anny v Brně
1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
2
Vyšlo v časopise:
Kardiol Rev Int Med 2018, 20(1): 66-70
Souhrn
Srdeční selhání se zachovalou ejekční frakcí levé komory je prakticky stejně časté a závažné onemocnění jako srdeční selhání se sníženou ejekční frakcí levé komory. Neinvazivní diagnostika tohoto stavu se opírá především o echokardiografické vyšetření. V současné době však neexistuje takový echokardiografický parametr, který by umožňoval jednoduché posouzení diastolické funkce. K přesnému stanovení diagnózy je nutné provést komplexní echokardiografické vyšetření k prokázání přítomnosti strukturálního postižení myokardu a/ nebo funkčních změn srdce. K tomuto posouzení se používají strukturální parametry, pulzní dopplerovská analýza transmitrálního plnění levé komory a toků v plicních žilách a stanovení diastolických rychlostí pohybu myokardu a mitrálního anulu tkáňovou dopplerovskou echokardiografií. Své místo v diagnostice diastolické dysfunkce již má i speckle tracking echokardiografie a hodnocení stupně deformace myokardu. Mnoho dalších parametrů je pak předmětem rozsáhlého klinického výzkumu.
Klíčová slova:
srdeční selhání se zachovalou ejekční frakcí – diastolická dysfunkce – echokardiografie
Úvod
Srdeční selhání se zachovalou ejekční frakcí levé komory (heart failure with preserved ejection fiction – HFpEF) je závažným klinickým a epidemiologickým stavem. Prevalence v evropské populaci je asi 1,3 % a incidence roste každým rokem. Celkově představují pacienti s HFpEF 22– 73 % ze všech pacientů s chronickým srdečním selháním (CHSS). Oproti pacientům se srdečním selháním se sníženou ejekční frakcí (heart failure with reduced ejection fraction – HFrEF) jsou pacienti s HFpEF průměrně starší, převážně se jedná o ženy, častěji trpí arteriální hypertenzí a fibrilací síní (FS), zatímco infarkt myokardu (IM) se v jejich anamnéze vyskytuje zřídka. Ačkoli je celková mortalita pacientů s HFpEF o něco nižší než u pacientů s HFrEF, je jejich prognóza stále velmi špatná, diagnostika i léčba velmi náročná a celkově toto onemocnění představuje důležitý medicínský, ekonomický a sociální problém [1– 3].
Patofyziologie
Patofyziologické mechanizmy u HFpEF na rozdíl od HFrEF dosud nejsou jednoznačně objasněny [4]. Základním mechanizmem je především porucha hemodynamiky v důsledku poruchy relaxace a/ nebo zvýšené tuhosti stěny levé komory (LK) srdeční. Důsledkem těchto změn je progrese remodelace myokardu často provázená intersticiální fibrózou [5]. Další příčinou může být hypertrofie kardiomyocytů jako kompenzační mechanizmus při zvýšeném napětí stěny komory, sama o sobě však k rozvoji nemoci nestačí [6,7]. Méně často je příčinou konstrikce myokardu nebo některé tachyartymie [8]. Hlavní rizikové faktory pro vznik HFpEF představují vyšší věk, ženské pohlaví, arteriální hypertenze, FS a diabetes mellitus (DM) [9].
Všechny tyto patofyziologické změny vedou k rozvoji poruchy diastolické funkce LK srdeční (diastolická dysfunkce – DD), proto toto onemocnění bylo označováno jako diastolické SS. Od tohoto pojmu se však upustilo, jelikož i pacienti s DD mohou mít poruchu longitudinální systolické funkce LK při normální ejekční frakci (EF) [10,11].
Diagnostika
Dle doporučení ESC z roku 2016 je SS definováno jako klinický syndrom s typickými syndromy (např. dušnost, únava a další), jež mohou být doprovázeny známkami (např. zvýšená náplň krčních žil, chrůpky na plicích, hepatojugulární reflex, otoky kolem kotníků a další). Pro diagnostiku HFpEF musí být splněna následující 4 kritéria [1]:
- přítomnost symptomů a/ nebo příznaků srdeční slabosti,
- zachovalá EF LK ≥ 50 %,
- zvýšené hodnoty natriuretických peptidů (BNP > 35 pg/ ml nebo NT-proBNP > 125 pg/ ml),
- alespoň jedno ze 2 kritérií:
- významné strukturální onemocnění srdce (hypertrofie LK a/ nebo zvětšení levé síně),
- diastolická dysfunkce.
Neinvazivní diagnostika tohoto stavu tedy zahrnuje podrobné odebrání anamnézy, fyzikální vyšetření, laboratorní vyšetření krve včetně stanovení hladiny natriuretických peptidů, RTG srdce a plic, EKG a echokardiografii [1– 3]. Právě echokardiografické vyšetření se stává zlatým standardem ke stanovení správné diagnózy. Umožňuje nejlépe prokázat a kvantifikovat poruchu funkce LK i PK, strukturální i hemodynamické změny a mnoho dalších důležitých parametrů. Stanovení DD je však stále problematické, jelikož dosud neexistuje takový jednoduchý parametr, jaký představuje EF pro posouzení funkce systolické [4].
Echokardiografické parametry
Echokardiografickými parametry u HFpEF se zabývala studie CARRY-IN-HFpEF [12]. K přesnému stanovení diagnózy dle doporučení ESC 2016 je nutné prokázat přítomnost strukturálního postižení myokardu a/ nebo funkčních změn srdce jako základní příčiny HFpEF [1– 3]. K vyhodnocení diastolické funkce pomocí echokardiografických parametrů se používá především pulzní dopplerovská analýza transmitrálního plnění LK a toků v plicních žilách a stanovení diastolických rychlostí pohybu myokardu a mitrálního anulu tkáňovou dopplerovskou echokardiografií [3].
Strukturální parametry
Strukturální změny myokardu spojené s poruchou diastolické funkce představují nález hypertrofie stěny LK a/ nebo zvětšený objem levé síně.
Left ventricle mass index, relative wall thickness
Left ventricle mass index (LVMi) je index hmotnosti LK a umožňuje stanovit její hypertrofii. Vychází z geometrických modelů, jejichž platnost byla ověřena srovnáváním s anatomicko-patologickými měřeními [13]. K hodnocení lze použít zobrazení 2D, M mode nebo 3D echokardiografii. Všechny modely představují určité zjednodušení skutečnosti. Poslední verze společných doporučení Americké společnosti pro echokardiografii a Evropské kardiologické společnosti z roku 2015 využívá k posouzení LVMi pouze 2D zobrazení v parasternální projekci dlouhé osy v enddiastole, kde stanovuje enddiastolický rozměr LK (left ventricular end diastolic diameter – LVEDD), diastolický rozměr interventrikulárního septa (interventricular septal end diastole – IVSd) a diastolický rozměr zadní stěny LK (posterior wall thickness – PWd) [14]. K výpočtu se používá formule dle Devereuxe, kterou většinou vyhodnotí přístroj automaticky [15]. Získaná hodnota je dále indexována na povrch těla. Za hypertrofii LK jsou považovány hodnoty ≥ 115 g/ m2 pro muže a ≥ 95 g/ m2 pro ženy [14].
Pomocí zobrazovacích technik lze popsat několik typů strukturální remodelace s odlišným prognostickým významem. Ke stratifikaci je využíváno hodnocení celkové hmotnosti LK, jejího objemu a relativní tloušťky myokardu (relative wall thickness – RWT). Jsou-li splněna kritéria pro hypertrofii, pak hodnoty RWT > 0,42 svědčí pro hypertrofii koncentrickou a hodnoty RWT < 0,42 pro hypertrofii excentrickou [16].
Left atrial volume index
Dalším strukturálním parametrem je velikost levé síně (left atrial volume index – LAVi), která je hodnocena jejím objemem, a především indexovaná podoba objemu na plochu těla. Objem levé síně se standardně stanovuje pomocí 2D zobrazení v projekci od hrotu v end systole komor, kdy má síň maximální velikost. Stanovení objemu se poté provádí výpočtem ploch levé síně z projekcí na sebe kolmých (A1 a A2) a délky L, což je kolmá vzdálenost od středu roviny mitrálního anulu k horní části levé síně. Výsledek je vztažen na celkový povrch těla. Výpočet většinou provádí přístroj automaticky. Za patologickou hodnotu se považuje LAVi > 34 ml/ m2 [16].
Pulzní dopplerovská analýza
Při této analýze hodnotíme průtok mitrální chlopní v době diastoly komory a průtok plicními žilami pulzním Dopplerem. Tyto parametry nám dávají první informaci o možném zvýšeném plnicím tlaku LK (obr. 1.)
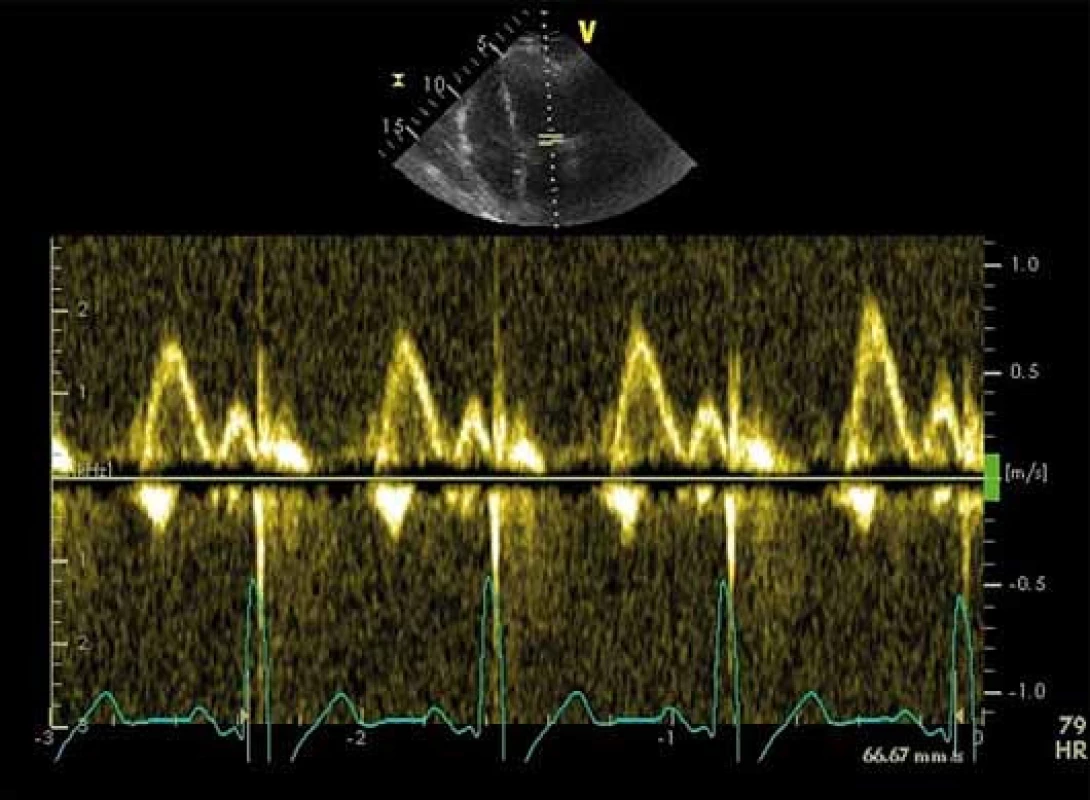
Vlna E, vlna A, decelerační čas, izovolumická relaxační perioda
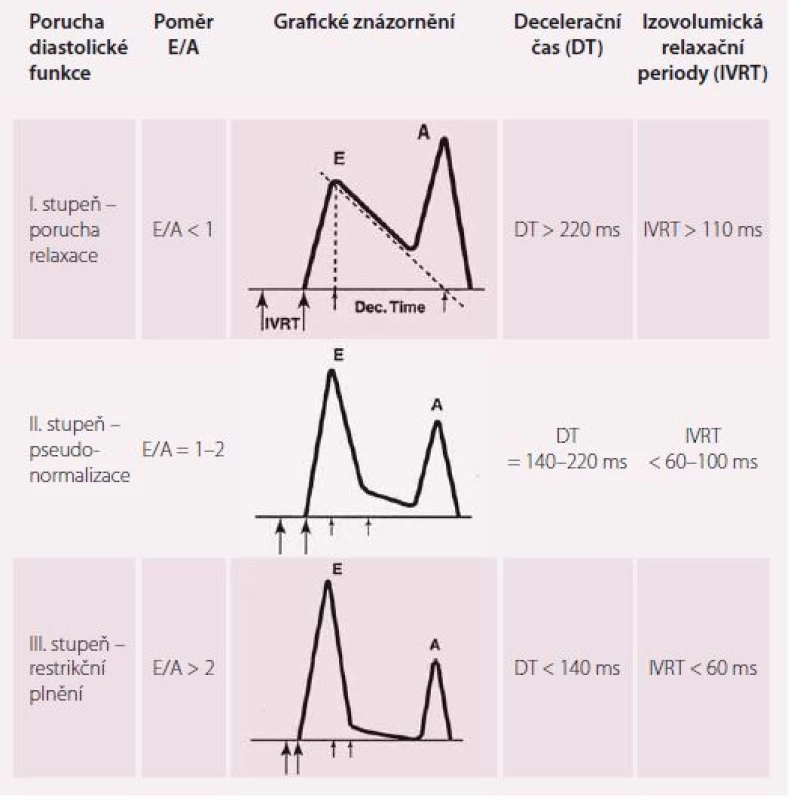
Základní parametry transmitrálního toku z pulzní dopplerovské analýzy jsou: vrcholová rychlost plnění LK v časné diastole (vlna E), vrcholová rychlost plnění LK při síňovém stahu (vlna A) a decelerační čas (DT). Vlna E odpovídá tlakovému gradientu mezi levou síní a komorou. Vlna A představuje pozdní diastolické plnění vyvolané kontrakcí levé síně. Je přítomná pouze při sinusovém rytmu. DT je časový interval mezi vrcholem a ukončením toku při diastolickém plnění LK [17]. Cenné je i stanovení izovolumické relaxační periody (IVRT), kterou změříme jako dobu mezi koncem aortálního toku v systole a začátkem časného diastolického plnění. IVRT lze takto získat z čtyřdutinové apikální projekce umístěním vzorkovacího objemu do výtokového traktu LK blíže k přednímu cípu mitrální chlopně [18]. Za normálního stavu dosahuje vlna A značně nižší rychlosti, takže poměr E/ A je větší než 1,0, DT nepřesahuje 220 ms, IVRT nepřesahuje 100 ms. Typy diastolické dysfunkce hodnocené pomocí parametrů E, A, DT a IVRT ukazuje tab. 1. Z tabulky je patrné, že při progresi diastolické dysfunkce LK jednotlivé parametry prodělávají nelineární průběh, a proto sami o sobě k posouzení diastolické funkce nestačí. Dopplerovské parametry transmitrálního plnění LK jsou navíc ovlivněny celou řadou faktorů, které interpretaci jejich hodnot ještě ztěžují, jako jsou afterload a preload, tepový objem, srdeční frekvence a další [18].
Vlna S, vlna D, doba trvání reverzního toku A
Především II. stupeň diastolické dysfunkce označovaný jako pseudonormalizace je od normálního plnění LK pomocí základních parametrů transmitrálního plnění těžko odlišitelný. K přesnější diagnóze pomáhá analýza průtoku plicními žilami. K vyšetření se používá pravá plicní žíla a vzorkovací objem se umísťuje asi 0,5 cm před jejím vyústěním do levé síně. Měříme rychlost dopředného toku v systole (vlna S) a diastole (vlna D) a dobu trvání reverzního toku v době síňové kontrakce (Ard). Trvání reverzní vlny Ard plicními žilami je u pacientů s diastolickou dysfunkcí delší, než je trvání dopředné vlny A transmitrálního průtoku, za citlivý znak zhoršené distenzibility se považuje rozdíl > 30 ms [1– 3].
Tkáňová dopplerovská analýza
Tkáňová dopplerovská echokardiografie využívá měření longitudinálně orientovaných rychlostí pohybu mitrálního anulu, který odráží rychlost podélného prodlužování a zkracování vláken myokardu. Získané parametry jsou méně ovlivněny preloadem než dopplerovské parametry plnění LK. Měření analogických parametrů na trikuspidálním anulu umožní neinvazivně hodnotit a kvantifikovat i funkci PK [1,2].
Vlna e’, vlna a’, vlna s’, E/ e’
Tyto parametry získáme tkáňovým dopplerovským zobrazením pohybu septa a laterální strany mitrálního anulu v čtyřdutinové apikální projekci. Jedná se o vrcholnou rychlost pohybu mitrálního anulu v systole (vlna s’), v časné (vlna e’) a pozdní (vlna a’) diastole. Vlna e’ je považována za měřítko relaxace komory. V praxi používáme poměr E/ e’, který dobře koreluje s hodnotami tlaku v zaklínění (pulmonary artery wedge pressure – PCWP) získanými invazivními metodami, a odráží tak hodnoty plnicího tlaku LK [18]. Pro přesnější měření je výhodné použít průměrnou e’ rychlost získanou ze septa a boční stěny mitrálního anulu, vzhledem k tomu, že septální e' je obvykle nižší než laterální e’. Poměr E/ e’ < 8 je spojen s normálním tlakem v zaklínění (PCWP < 15 mm Hg), zatímco poměr E/ e’ > 13 je spojen se zvýšeným tlakem v zaklínění (PCWP > 15 mm Hg) a využívá se v diagnostice HFpEF. Mezi 8 a 13 se nachází šedá zóna s překrývající se hodnotou plnicích tlaků (obr. 2) [1,2,19].
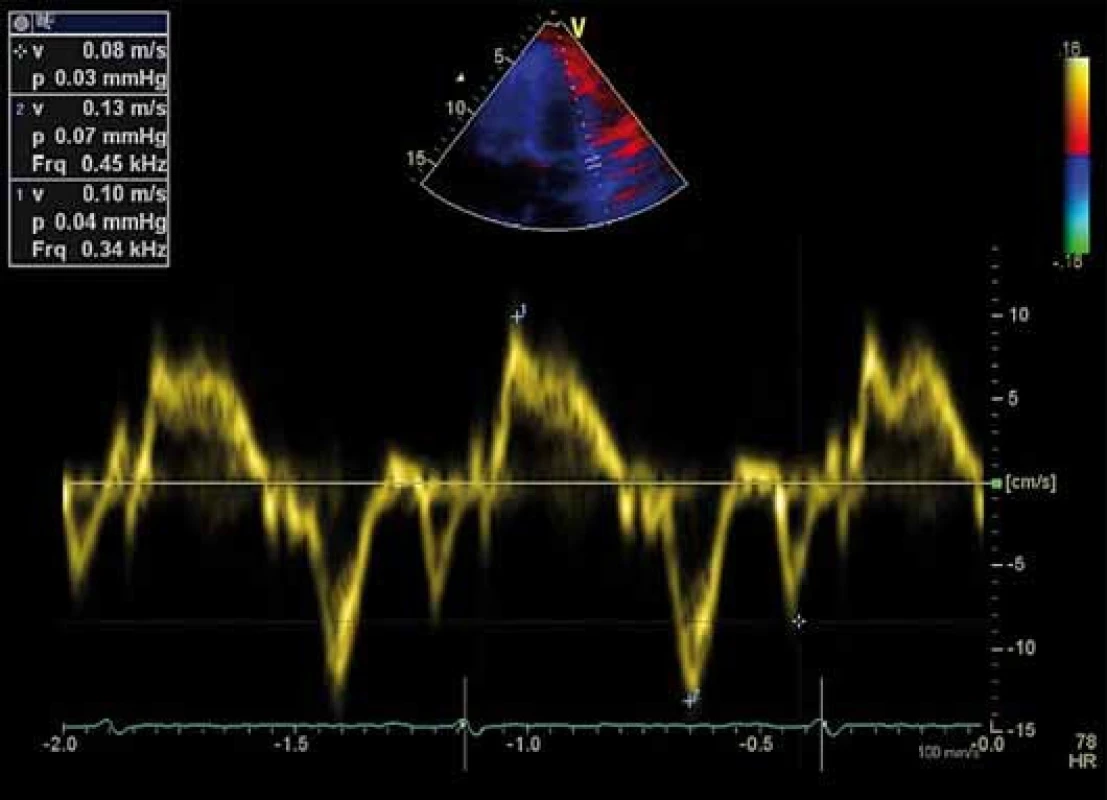
Speckle tracking echokardiografie
V hodnocení diastolické dysfunkce mohou být velmi užitečné i informace o stupni deformace myokardu (strain – ε) a rychlosti deformace (strain rate – ε’). K jejich získání můžeme využít tkáňovou dopplerovskou echokardiografii nebo speckle tracking echokardiografii. Princip této metody je identifikace velmi specifických ultrazvukových skvrn (speckle), které vznikají na základě detekce vektorů rychlosti jednotlivých částí myokardu a interference ultrazvukových vln. Tyto obrazce jsou jedinečné pro každou oblast. Vzájemná změna pozice těchto skvrn (ΔL) umožňuje pomocí speciálního software určit hodnotu strain a strain rate v určitém časovém intervalu (Δt). Pomocí speckle tracking echokardiografie tak lze získat současně informaci o longitudinální, radiální a cirkumferenciální funkci myokardu [20,21]. Strain rate se již používá k hodnocení globální a regionální systolické funkce, byly však publikovány práce, které ukazují korelaci těchto parametrů se zvýšeným PCWR, a tím poruchou diastolické funkce [22,23].
Nové parametry ve výzkumu
Jak vyplývá z předešlého textu, je neinvazivní diagnostika HFpEF stále poměrně složitá a k hodnocení diastolické dysfunkce neinvazivními metodami je třeba stanovit více parametrů, které je nutné dát do správných souvislostí a hodnotit komplexně. Proto je předmětem rozsáhlého klinického výzkumu snaha najít takový parametr, který by umožnil jednoduše posoudit diastolickou funkci, jako je např. EF k posouzení funkce systolické. Parametry, které se jeví jako nadějné, jsou např. diastolic wall strain of posterior wall (DWS PW) a vortex formation time (VFT) a mnohé další.
Diastolic wall strain of posterior wall
Diastolic wall strain of posterior wall (DWS PW) je parametr, který vychází z předpokladu, že diastolická dysfunkce je dána sníženou schopností ztenčování stěn LK v diastole, což určuje odolnost myokardu proti deformaci, a tím odráží tuhost stěny LK. DWS PW lze tedy získat změřením tloušťky zadní stěny v enddiastole (PWd) a end systole (PWs). Byly již publikovány práce, které prokázaly výrazně nižší hodnoty DWS PW u pacientů s HFpEF [24– 26].
Vortex formation time
Vortex formation time (VFT) je parametr, který vychází z předpokladu tvorby rotačního proudu krve během transmitráního toku v časné diastole. Optimální formace transmitrálního víru ovlivňuje jednotlivé objemové a energetické parametry toku, a tím efektivitu cirkulace. Dosažení optimální tvorby víru vyžaduje zachovalou plnicí funkci LK, správně fungující mitrální chlopeň a normální elektrický převodní systém. Stanovení VFT tak vychází z parametrů Dopplerovské echokardiografie (velocity time integral – VTI), průměru mitrálního anulu (D), enddiastolického objemu LK (EDV) a EF (LVEF) [26– 29].
Závěr
Nemocní s HFpEF představují heterogenní skupinu pacientů s různými základními etiologiemi a patofyziologickými abnormalitami. Žádná jediná echokardiografická proměnná není natolik přesná, aby bylo možno ji samostatně použít ke stanovení diagnózy diastolické dysfunkce LK. Proto je vždy nutné provést komplexní echokardiografické vyšetření zahrnující všechny dvojrozměrné i dopplerovské údaje a získané údaje správně interpretovat (tab. 2). Nové echokardiografické metody a parametry jsou předmětem rozsáhlého klinického výzkumu, který by měl vést ke zpřesnění, ale také zjednodušení diagnostiky HFpEF.
![Přehled nejdůležitějších echokardiografických parametrů v diagnostice HFpEF [1].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/ea7efd5359e8a016f724c3ec1067d280.jpg)
Doručeno do redakce: 27. 12. 2017
Přijato po recenzi: 17. 1. 2018
MU Dr. Monika Špinarová, MSc.
Zdroje
1. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37(27): 2129– 2200. doi: 10.1093/ eurheartj/ ehw128.
2. Špinar J, Hradec J, Špinarová L et al. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Připraven Českou kardiologickou společností. Cor Vasa 2016; 58(5): 597– 636.
3. Špinar J, Vítovec J, Špinarová L. Srdeční selhání se zachovanou ejekční frakcí. Vnitř Lék 2016; 62(7– 8): 646– 651.
4. Yamamoto K, Sakata Y, Ohtani T et al. Heart failure with preserved ejection fraction. Circ J 2009; 73(3): 404– 410.
5. Owan TE, Hodge DO, Herges RM et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006; 355(3): 251– 259.
6. Yamamoto K, Masuyama T, Sakata Y et al. Roles of renin-angiotensin and endothelin systems in development of diastolic heart failure in hypertensive hearts. Cardiovasc Res 2000; 47(2): 274– 283.
7. Koitabashi N, Arai M, Kogure S et al. Increased connective tissue growth factor relative to brain natriuretic peptide as a determinant of myocardial fibrosis. Hypertension 2007; 49(5): 1120– 1127.
8. Pudil R. Srdeční selhání se zachovalou ejekční frakcí. Labor aktuell – časopis pro klienty Roche Diagnostics v České a Slovenské republice 2017; (2): 4– 7.
9. Gregorová Z, Meluzín J, Špinarová L. Co je nového v srdečním selhání se zachovalou ejekční frakcí levé komory za posledních pět let? Vnitř Lék 2014; 60(7– 8): 586– 594.
10. McMurray J, Pfeffer MA. New therapeutic options in congestive heart failure: Part II. Circulation 2002; 105(18): 2223– 2228.
11. Gregorova Z, Meluzin J, Stepanova R et al. Longitudinal, circumferential and radial systolic left ventricular function in patients with heart failure and preserved ejection fraction. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2016; 160(3): 385– 392.
12. Cioffi G, Senni M, Tarantini L et al. Analysis of circumferential and longitudinal left ventricular systolic function in patients with non-ischemic chronic heart failure and preserved ejection fraction (from the CARRY-IN-HFpEF study). Am J Cardiol 2012; 109(3): 383– 389. doi: 10.1016/ j.amjcard.2011.09.022.
13. Linhart A. Echokardiografické hodnocení strukturálních změn levé komory u hypertenze. Hypertenze a kardiovaskulární prevence 2015; 4(2): 39– 43.
14. Lang RM, Badano LP, Mor-Avi V et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015; 16(3): 233– 270. doi: 10.1093/ ehjci/ jev014.
15. Devereux RB, Alonso DR, Lutas EM et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings. Am J Cardiol 1986; 57(6): 450– 458.
16. Nagueh SF, Smiseth OA, Appleton CP et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2016; 17(12): 1321– 1360.
17. Špinar J, Vítovec J, Hradec J et al. Doporučený postup České kardiologické společnosti pro diagnostiku a léčbu chronického srdečního selhání, 2011. Cor Vasa 2012; 54(3– 4): 161– 182.
18. Meluzín J. Odhad vzestupu plnícího tlaku levé komory pomocí echokardiografie. Interv Akut Kardiol 2009; 8(3): 128– 133.
19. Nagueh SF, Middleton KJ, Kopelen HA et al. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures. J Am Coll Cardiol 1997; 30(6): 1527– 1533.
20. Hutyra M, Skála T, Kamínek M et al. Speckle tracking echokardiografie – nová ultrazvuková metoda hodnocení globální a regionální funkce myokardu. Kardiol Rev 2008; 10(1): 8– 13.
21. Dandel M, Lehmkuhl H, Knosalla C et al. Strain and strain rate imaging by echocardiography – basic concepts and clinical applicability. Curr Cardiol Rev 2009; 5(2): 133– 148. doi: 10.2174/ 157340309788166642.
22. Wang J, Khoury DS, Thohan V et al. Global diastolic strain rate for the assessment of left ventricular relaxation and filling pressures. Circulation 2007; 115(11): 1376– 1383.
23. Meluzin J, Spinarova L, Hude P et al. Estimation of left ventricular filling pressures by speckle tracking echocardiography in patients with idiopathic dilated cardiomyopathy. Eur J Echocardiogr 2011; 12(1): 11– 18. doi: 10.1093/ ejechocard/ jeq088.
24. Takeda Y, Sakata Y, Higashimori M et al. Noninvasive assessment of wall distensibility with the evaluation of diastolic epicardial movement. J Card Fail 2009; 15(1): 68– 77. doi: 10.1016/ j.cardfail.2008.09.004.
25. Ohtani T, Mohammed SF, Yamamoto K et al. Diastolic stiffness as assessed by diastolic wall strain is associated with adverse remodelling and poor outcomes in heart failure with preserved ejection fraction. Eur Heart J 2012; 33(14): 1742– 1749. doi: 10.1093/ eurheartj/ ehs135.
26. Špinarová M, Meluzín J, Podroužková H et al. New echocardiographic parameters in the diagnosis of heart failure with preserved ejection fraction. Int J Cardiovasc Imag 2017; 34(2): 229– 235.
27. Gharib M, Rambod E, Kheradvar A et al. Optimal vortex formation as an index of cardiac health. Proc Natl Acad Sci USA 2006; 103(16): 6305– 6308.
28. Kheradvar A, Assadi R, Falahatpisheh A et al. Assessment of transmitral vortex formation in patients with diastolic dysfunction. J Am Soc Echocardiogr 2012; 25(2): 220– 227. doi: 10.1016/ j.echo.2011.10.003.
29. Poh KK, Lee LC, Shen L et al. Left ventricular fluid dynamics in heart failure: echocardiographic measurement and utilities of vortex formation time. Eur Heart J Cardiovasc Imaging 2012; 13(5): 385– 393. doi: 10.1093/ ejechocard/ jer288.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2018 Číslo 1
Nejčtenější v tomto čísle
- Přehled echokardiografických parametrů v diagnostice srdečního selhání se zachovalou ejekční frakcí levé komory
- Specifika diagnostiky a léčby ve stáří
- Srdeční selhání ve stáří
- Tyreopatie ve stáří a kardiovaskulární postižení







