Farmakologická a nefarmakologická léčba fibrilace síní – současný pohled
Pharmacological and non-pharmacological treatment of atrial fibrillation – a current view
Atrial fibrillation (AF) is the most common cardiac arrhythmia in developed countries. The presence of AF increases the risk of stroke, heart failure, dementia and death. Although antiarrhythmic drugs have an important role in the treatment of AF, catheter ablation in most aspects provides better treatment results and in some cases may lead to a cure. This article summarises the current view on the treatment of AF, with special emphasis on catheter ablation.
Keywords:
atrial fibrillation – catheter ablativ – antiarrhythmic therapy
Autoři:
J. Petrů
Působiště autorů:
Kardiocentrum, Nemocnice Na Homolce, Praha
Vyšlo v časopise:
Kardiol Rev Int Med 2015, 17(3): 221-224
Kategorie:
Kardiologická revue
Souhrn
Fibrilace síní je nečastější srdeční arytmií ve vyspělých státech, její přítomnost zvyšuje riziko mozkové mrtvice, srdečního selhání, demence a úmrtí. Přestože antiarytmika mají významnou roli v léčbě fibrilace síní, katetrizační ablace přináší ve většině aspektů lepší výsledky léčby a v některých případech může vést i k vyléčení. Článek shrnuje současný pohled na léčbu fibrilace síní s důrazem především na katetrizační ablaci.
Klíčová slova:
fibrilace síní – katetrizační ablace – antiarytmika
Úvod
Fibrilace síní (FS) je v rozvinutých zemích nejčastější srdeční arytmií se stoupající prevalencí (1,5– 2 %) i incidencí [1]. Přesné důvody epidemie FS nejsou známy, uvažovanými faktory jsou především stárnutí populace a zvyšující se incidence kardiometabolického syndromu. Přítomnost FS zvyšuje 5× riziko cévní mozkové příhody, 3× riziko srdečního selhání a 2× riziko rozvoje demence a úmrtí [2]. Jelikož se jedná o multifaktoriální onemocnění s měnlivým patofyziologickým podkladem, musí být přístup k léčbě této arytmie komplexní a výrazně individuální. Jednotlivé terapeutické postupy se v průběhu léčby střídají, doplňují a upravují dle vývoje a stadia onemocnění. Základem je vždy redukce rizika či recidivy cévní mozkové příhody [3]. Dobře zvolená léčba by měla u daného pacienta upravit symptomy, zvýšit kvalitu života, snížit morbiditu, mortalitu a rozvoj demence. Nejnovější doporučení pro diagnostiku a léčbu FS byla publikována v časopisu Circulation v březnu 2014 [4]. V následujícím textu se budeme více věnovat správným postupům z hlediska výběru antiarytmik a indikací ke katetrizační ablaci.
Farmakologická léčba fibrilace síní
Antiarytmika stále (i v éře katetrizačních ablací) hrají významnou roli v léčbě FS, a to přes jejich podstatné limitace – nedostatečnou účinnost a riziko nežádoucích (kardiálních i nekardiálních) účinků. Existují dva základní principy léčby FS, a to kontrola rytmu (tzn. snaha o dosažení a udržení sinusového rytmu) nebo kontrola frekvence (tzn. ovlivnění výsledné tepové frekvence při perzistující FS). Rozhodování mezi těmito dvěma strategiemi závisí na mnoha faktorech, jako jsou věk pacienta, symptomy, typ FS (paroxysmální × perzistující × dlouhodobě perzistující), přidružené srdeční onemocnění (dilatace levé síně, funkce levé komory, chlopenní vady apod.), ostatní komorbidity a v neposlední řadě zkušenost lékaře a míra spolupráce pacienta a lékaře.
Pokud zvolíme jako základní strategii terapie FS kontrolu frekvence, pak se nejčastěji v léčbě používají betablokátory, dále nondihydropiridinové blokátory kalciového kanálu (verapamil), digoxin a vzácněji amiodaron. Při kontrole rytmu je v českých podmínkách nejčastěji používaným antiarytmikem propafenon, amiodaron a sotalol. Dronedaron – strukturální analog amiodaronu a původně nadějný lék – se užívá méně pro prokázanou menší účinnost a dle současných doporučení má být indikován jen u pacientů s nepermanentní FS a při absenci srdečního selhávání [5]. Nejúčinnější z výše uvedených léků je amiodaron, který se dá podávat i při srdečním selhání a dysfunkci levé srdeční komory. Zároveň má ale i nejčastější a nejzávažnější nežádoucí účinky (fotosenzitivita, dysfunkce štítné žlázy, plicní a jaterní toxicita, bradykardie, oční komplikace). Proto by měl být amiodaron indikován jen v případě selhání nebo kontraindikací jiných antiarytmik [4]. Při léčbě amiodaronem se sinusový rytmus udrží v průběhu jednoho roku sledování přibližně u 65 % pacientů, u ostatních antiarytmik kolísá účinnost jen v rozmezí 30– 50 % [5– 7]. V porovnání s katetrizační ablací jsou dle metaanalýzy výsledky antiarytmické léčby u paroxysmální a perzistentní FS, jak bude zmíněno dále, signifikantně horší a ještě k tomu za cenu častějších nežádoucích účinků [8]. Z dané metaanalýzy vyplývají i lepší výsledky (zlepšení funkce levé srdeční komory, zmírnění projevů srdečního selhání) v případě volby kontroly rytmu pomocí katetrizační ablace oproti farmakologické terapii a dokonce i strategii kontroly tepové frekvence. Postup při strategii kontroly rytmu ukazuje obr. 1.
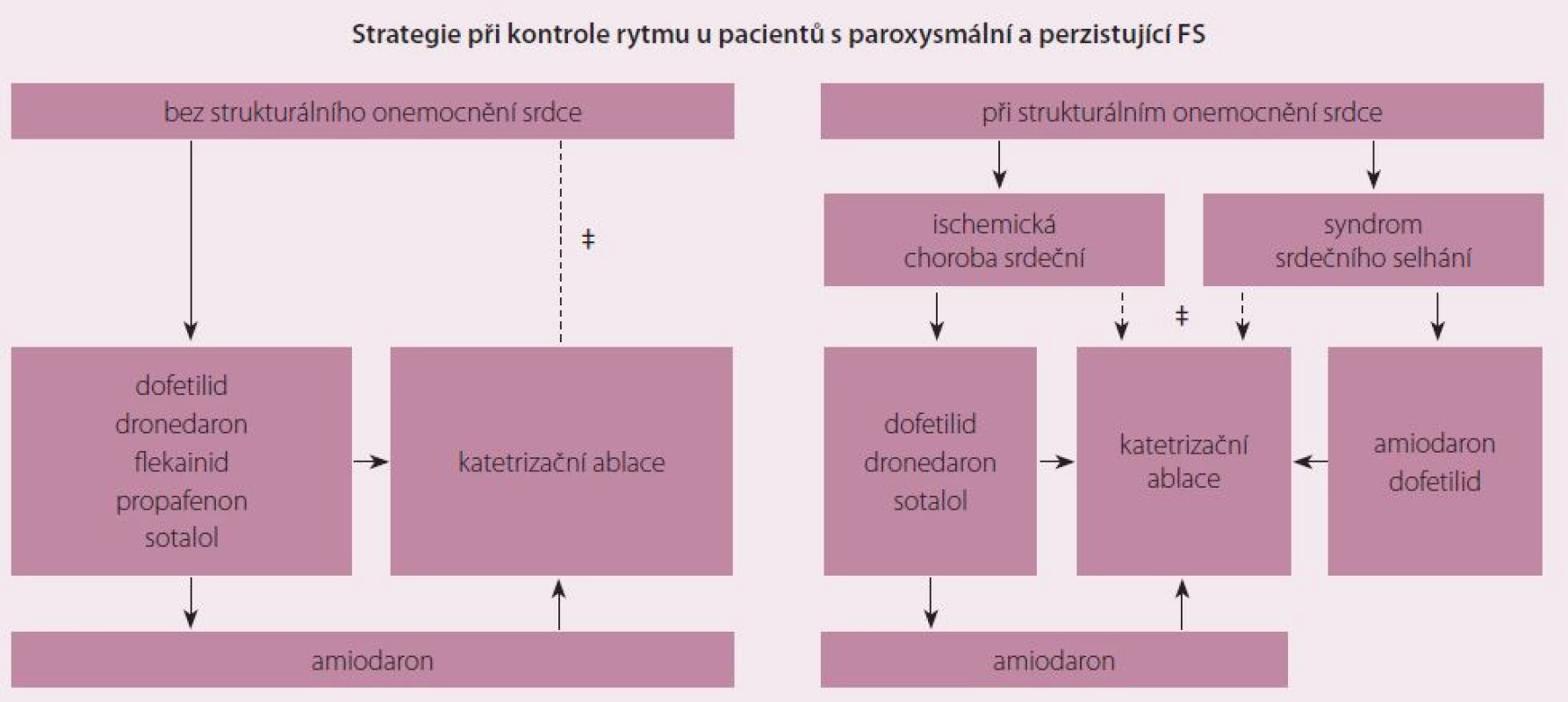
Katetrizační ablace FS
Katetrizační ablace FS prodělala za posledních 20 let zásadní změny. Od pionýrských dob 90. let, kdy byla ablace FS zcela raritní a „fokální ložiska“ fibrilace síní byla mapována a ablována přímo v plicních žilách (poprvé M. Haissaguerre, 1994), se katetrizační ablace FS v posledních deseti letech stala metodou běžnou, jejímž základem je provedení extraostiální/ antrální izolace plicních žil [9]. Publikovaná úspěšnost ablace FS se pohybuje v širokém rozmezí 50– 90 % a závisí na mnoha faktorech, jako jsou např. velikost levé síně, zkušenost operatéra/ centra, výběr ablační metody a technologie, typ FS, přítomné komorbidity, délka sledování, metody monitorace srdečního rytmu po ablaci, podávání antiarytmik apod. Minimálně osm randomizovaných studií prokázalo, že katetrizační ablace paroxysmální či krátce perzistující formy FS u nemocných, u kterých selhala antiarytmická léčba, přináší signifikantně lepší výsledky ve smyslu udržení sinusového rytmu [10– 13]. Především na výsledcích těchto studií jsou založena současná indikační kritéria k ablaci FS v nejnovějších amerických doporučeních [4].
Při strategii kontroly srdečního rytmu má být tedy katetrizační ablace jednoznačně indikována v případech symptomatické paroxysmální FS po selhání či při intoleranci antiarytmik (třída I, úroveň důkazu A). Vhodné je indikovat katetrizační ablaci i u nemocných s perzistující symptomatickou FS a selháním antiarytmické léčby (IIa/ A). U vybraných nemocných s paroxysmální FS může být katetrizační ablace dokonce zvolena jako léčba první volby, tzn. ještě před zahájením antiarytmické léčby (IIa/ B). Pro katetrizační ablaci dlouhodobě perzistující FS nemáme v současnosti ještě dostatek dat z randomizovaných studií (dle doporučení indikace v případě symptomů a selhání antiarytmik – IIb/ B). U asymptomatických pacientů nemáme o účinnosti ablace dostatek důkazů, a proto by měla být katetrizační ablace zvážena v tomto případě u mladých pacientů či při podezření na tachykardickou kardiomyopatii [14]. Výběr vhodného kandidáta k ablaci přehledně ukazuje tab. 1.

Z randomizovaných studií a publikovaných prací především velkých center vyplývá, že jednoroční úspěšnost ablační léčby je cca 70– 90 % [10– 12]. S nárůstem doby od ablace se riziko recidivy FS zvyšuje, jak prokázali např. Bertaglia et al [15] a Weerasooriya et al [16]. Bertaglia ve svém souboru 177 pacientů s paroxysmální i perzistující FS, kteří podstoupili jednu katetrizační ablaci a u nichž nebyla v průběhu prvních 12 měsíců zaznamenána žádná epizoda FS, hodnotili riziko recidivy FS v dalších letech. Během střední doby sledování 49,7 ± 13,3 měsíců došlo k recidivě FS u významných 41,8 % pacientů (74/ 177) a vypočtené riziko recidivy bylo 13 % po dvou letech, 21,8 % po třech letech, 35 % po čtyřech letech, 46,8 % po pěti letech a 54,6 % po šesti letech sledování. Hlavním prediktorem recidivy v této studii byla velikost levé síně [15]. Další důležité nezávislé rizikové faktory jsou věk, ženské pohlaví, předchozí selhání antiarytmik, přítomnost ICHS a perzistující, resp. dlouhodobě perzistující FS.
Mechanizmů, proč arytmie po ablaci recidivuje, je několik. Ale zásadní jsou gapy (místa v ablační linii, kde došlo k obnovení vedení elektrického signálu), které prokazujeme až v 95 % při opakování katetrizační ablace. Reablace – i třeba několikrát – prokazatelně zvyšují účinnost ablační léčby. Weerasooriya et al prokázali na souboru 100 pacientů, že v průměru po dvou ablacích nedochází k recidivám FS u 87 %, 81 % a 63 % po jednom, dvou a pěti letech od poslední ablace. Na rozdíl po první (jedné) ablaci, kde úspěšnost udržení sinusového rytmu byla v prvním, druhém a pátém roce jen 40 %, 37 %, resp. 29 % [16]. Katetrizační ablace tedy není dokonalou kurativní metodou FS. Přesto je to v současné době to nejlepší, co našim pacientům můžeme nabídnout. Každý pacient podstupující katetrizační ablaci by měl být informován o pravděpodobnosti opakování ablace.
Stále netrpělivě čekáme na výsledky mortalitních studií, které by měly přinést informace o tom, zda katetrizační ablace může zlepšit prognózu nemocných a snížit kardiovaskulární mortalitu a riziko mozkové příhody (CABANA, EAST).
Katetrizační ablace ve specifických případech
Obezita a syndrom spánkové apnoe
U obézních nemocných je přínos katetrizační ablace FS omezený. Riziko možných perioperačních komplikací je větší a klinická účinnost menší. Vyplatí se proto obézní nemocné s FS motivovat a přesvědčit o významu hubnutí. Abed et al prokázali v randomizované studii, že systematické hubnutí signifikantně snižuje četnost recidiv FS a tíži symptomů. Čím větší je redukce hmotnosti, tím nižší riziko recidivy FS [17]. Ve skupině nemocných, kteří zhubli o více než 10 % původní váhy, bylo na konci sledování 45,5 % nemocných zcela bez záchytu FS a bez symptomů (a to dokonce bez antiarytmické léčby či ablace) na rozdíl od 22,2 % nemocných, kteří zhubli „jen“ mezi 3 a 9 % původní váhy (p < 0,001).
Častěji se u obézních pacientů vyskytuje syndrom obstrukční spánkové apnoe (OSA), který zpětně negativně ovlivňuje četnost FS. Správná léčba OSA snižuje četnost FS a přispívá i ke snížení počtu recidiv FS po katetrizační ablaci [18]. Ve dvouleté observační studii ORBIT‑ AF mělo z celkového počtu 10 132 zařazených pacientů obstrukční spánkovou apnoi 1 841 nemocných [19]. Tito pacienti měli horší symptomy a častěji byli hospitalizováni než pacienti bez OSA. Zároveň bylo zdokumentováno, že u pacientů, kterým byl aplikován CPAP, přechází FS méně často do permanentní formy.
Srdeční selhání
Přibývá informací, že selektivní katetrizační ablace u nemocných se srdečním selháním a FS přináší lepší výsledky než antiarytmická léčba či jakákoli strategie kontroly frekvence, včetně neselektivní radiofrekvenční ablace AV uzlu [14]. Přínos ablace může být u těchto pacientů dokonce významnější než u pacientů jinak poměrně zdravých, protože může vést k zásadnímu zlepšení ejekční frakce levé komory (EF LK), úpravě symptomů srdečního selhání a pravděpodobně i zlepšení prognózy. Nejnovější metaanalýza 26 studií (1 838 pacientů), které se zabývaly přínosem katetrizační ablace FS u nemocných se srdečním selháním, prokázala, že v průběhu střední doby sledování 23 měsíců se udržel sinusový rytmus po ablaci (resp. reablacích) u 60 % pacientů a byl zaznamenán signifikantní vzestup EF LK (o 13 % z původních 40 na 53 %), pokles hodnot pro‑BNP, zmírnění symptomů dle NYHA klasifikace a dle dotazníku kvality života [20]. Závěry jsou platné pro nemocné s dilatovanou kardiomyopatií i ischemickou chorobou srdeční, kterých bylo v daném souboru okolo 60 %.
Katetrizační ablace z hlediska periprocedurální antikoagulace
A ještě praktická poznámka na konec. Antikoagulační léčba v periprocedurálním období ablačního výkonu je extrémně důležitá, jelikož ovlivňuje rizika tromboembolických a krvácivých komplikací [21]. Z nejnovější metaanalýzy zahrnující celkem 13 studií (12 observačních, jednu randomizovanou – studie COMPARE) o celkovém počtu 17 434 nemocných vyplývá, že nepřerušované podávání warfarinu – oproti přerušení warfarinizace s aplikacemi heparinu či nízkomolekulárního heparinu – signifikantně snižuje riziko mozkové mrtvice, transientní ischemické ataky a všech (závažných i méně závažných) krvácivých komplikací [22]. Výsledky studií ctíme i v klinické praxi, a proto v periablačním období warfarin nevysazujeme a ablaci provádíme ideálně v terapeutickém rozmezí 2– 3 INR. Podobný postup platí i pro pacienty s novými antikoagulancii (NOAC) – vynechává se jen jedna dávka NOAC ráno před ablací.
Závěr
Léčba FS zažívá v poslední době výrazné změny. Více než dříve je kladen důraz na strategii kontroly rytmu, ve kterém má v současnosti jednoznačně dominantní postavení katetrizační ablace, a tato metoda se v některých případech stává i léčebnou strategií první volby. U nemocných se srdečním selháním je vždy nutné zvážit přínos katetrizační ablace, neboť může vést ke zlepšení funkce levé komory, úpravě symptomů a možná i prognózy. Katetrizační ablace má být prováděna ve specializovaných centrech, tak aby byl zajištěn co možná maximální klinický efekt a bezpečnost procedury.
Doručeno do redakce: 10. 7. 2015
Přijato po recenzi: 28. 7. 2015
MU Dr. Jan Petrů
www.homolka.cz
jan.petru@homolka.cz
Zdroje
1. Wolf PA, Benjamin EJ, Belanger AJ et al. Secular trends in the prevalence of atrial fibrillation: The Framingham Study. Am Heart J 1996; 131: 790– 795.
2. Ott A, Breteler MM, de Bruyne MC et al. Atrial fibrillation and dementia in a population‑based study. The Rotterdam Study. Stroke 1997; 28: 316– 321.
3. Lin HJ, Wolf PA, Kelly‑ Hayes M et al. Stroke severity in atrial fibrillation. The Framingham Study. Stroke 1996; 27: 1760– 1764.
4. January CT, Wann LS, Alpert JS et al. 2014 AHA/ ACC/ HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/ American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation 2014; 130. doi: 10.1161/ CIR.0000000000000041.
5. Le Heuzey JY, De Ferrari GM, Radzik D et al. A short‑term, randomized, double‑blind, parallel‑ group study to evaluate the efficacy and safety of dronedarone versus amiodarone in patients with persistent atrial fibrillation: the DIONYSOS study. J Cardiovasc Electrophysiol 2010; 21: 597– 605. doi: 10.1111/ j.1540– 8167.2010.01764.x.
6. Freemantle N, Lafuente‑ Lafuente C, Mitchell S et al. Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation. Europace 2011; 13: 329– 345. doi: 10.1093/ europace/ euq450.
7. Singh BN, Singh SN, Reda DJ et al. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005; 352: 1861– 1872.
8. Vaidya K, Arnott C, Russell A et al. Pulmonary vein isolation compared to rate control in patiens with atrial fibrillation: a systematic review and meta‑analysis. Heart Lung Circ 2015; 24: 744– 752. doi: 10.1016/ j.hlc.2015.02.025.
9. Haissaguerre M, Marcus FI, Fischer B et al. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases. J Cardiovasc Electrophysiol 1994; 5: 743– 751.
10. Pappone C, Augello G, Sala S et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF Study. J Am Coll Cardiol 2006; 48: 2340– 2347.
11. Stabile G, Bertaglia E, Senatore G et al. Catheter ablation treatment in patiens with drug‑refractory atrial fibrillation: a prospective, multi‑centre, randomized, controlled study. Eur Heart J 2006; 27: 216– 221.
12. Wilber DJ, Pappone C, Neuzil P et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patiens with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA 2010; 303: 333– 340. doi: 10.1001/ jama.2009.2029.
13. Tung R, Buch E, Shivkumar K et al. Catheter Ablation of Atrial Fibrillation. Circulation 2012; 126: 223– 229. doi: 10.1161/ CIRCULATIONAHA.111.048421.
14. Hsu LF, Hais P, Sanders P et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004; 351: 2373– 2383.
15. Bertaglia E, Tondo C, De Simone A et al. Does catheter ablation cure atrial fibrillation? Single‑procedure outcome of drug‑refractory atrial fibrillation ablation: a 6‑year multicentre experience. Europace 2010; 12: 181– 187. doi: 10.1093/ europace/ eup349.
16. Weerasooriya R, Khairy P, Litalien J et al. Catheter ablation for atrial fibrillation, are results maintained at 5 years of follow‑up? J Am Coll Cardiol 2011; 57: 160– 166. doi: 10.1016/ j.jacc.2010.05.061.
17. Abed HS, Witter GA, Leong DP et al. Effect of weight reduction and cardiometabolic risk factor management on symptom burden and severity in patiens with atrial fibrillation. JAMA 2013; 310: 2050– 2060. doi: 10.1001/ jama.2013.280521.
18. Gami AS, Somers VK. Implications of obstructive sleep apnea for atrial fibrillation and sudden cardiac death. J Cardiovasc Electrophysiol 2008; 19: 997– 1003. doi: 10.1111/ j.1540– 8167.2008.01136.x.
19. Holmquist F, Guan N, Zhu Z et al. Impact of obstructive sleep apnea and continuous positive airway pressure therapy on outcomes in patiens with atrial fibrillation – Results from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT‑ AF). Am Heart J 2015; 169: 647– 654. doi: 10.1016/ j.ahj.2014.12.024.
20. Anselmino M, Matta M, D’Ascenzo F et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: a systematic review and meta‑analysis. Circ Arrhythm Electrophysiol 2014; 7: 1011– 1018. doi: 10.1161/ CIRCEP.114.001938.
21. Santangeli P, Di Biase L, Horton R et al. Ablation of atrial fibrillation under therapeutic warfarin reduces periprocedural complications: evidence from a meta‑analysis. Circ Arrhythm Electrophysiol 2012; 5: 302– 311. doi: 10.1161/ CIRCEP.111.964916.
22. Nairooz R, Sardar P, Payne J et al. Meta‑analysis of major bleeding with uninterrupted warfarin compared to interrupted warfarin and heparin bridging in ablation of atrial fibrillation. Int J Cardiol 2015; 187: 426– 429. doi: 10.1016/ j.ijcard.2015.03.376.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2015 Číslo 3
Nejčtenější v tomto čísle
- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
