Léčebné postupy u námahové anginy pectoris
Therapeutic approaches in exertional angina pectoris
Stable exertional angina pectoris is a common manifestation of coronary artery disease. The treatment of angina involves pharmacological therapy and revascularization procedures. In all patients secondary prevention measures must be apllied and the treatment of anginal symptoms should start by medical intervention. Revascularization should be dedicated for patients with severe symptoms regardless of medication therapy and for patients in high cardiovascular risk. For prognostic stratification several methods can be used including clinical evaluation, left ventricular function assessment, stress tests and coronary angiography. Treatment of refractory angina is specific and includes some new pharmacological and non‑pharmacological options. In this article we present an overview of current treatment of stable angina pectoris.
Key words:
coronary artery disease – angina pectoris – pharmacological therapy
Autoři:
K. Kopřiva
Působiště autorů:
Kardiocentrum, Nemocnice Na Homolce, Praha
Vyšlo v časopise:
Kardiol Rev Int Med 2015, 17(3): 225-229
Kategorie:
Kardiologická revue
Souhrn
Stabilní námahová angina pectoris je jednou z častých manifestací ischemické choroby srdeční. Její léčba zahrnuje farmakoterapii a revaskularizační výkony. U všech pacientů by měla být aplikována sekundárně preventivní opatření a léčba anginózních symptomů má být zahájena ve formě farmakoterapie. Revaskularizace má být vyhrazena pro pacienty výrazně symptomatické přes medikamentózní léčbu a pro pacienty s vysokým kardiovaskulárním rizikem. K prognostické stratifikaci je možné použít několik metod, včetně klinického vyšetření, stanovení funkce levé komory, zátěžových testů a koronarografie. Specifická je léčba refrakterní anginy, která využívá některé nové farmakologické a nefarmakologické terapeutické možnosti. V článku prezentujeme přehled současné léčby stabilní anginy pectoris.
Klíčová slova:
ischemická choroba srdeční – angina pectoris – farmakoterapie
Úvod
Námahová angina pectoris (AP) patří mezi stabilní formy ischemické choroby srdeční (ICHS). Je charakterizována epizodami bolesti na hrudi při reverzibilní ischemii způsobené nepoměrem mezi nároky myokardu a jeho zásobením. Ataky anginózní bolesti jsou nejčasněji vyvolány fyzickou námahou nebo emočním stresem, ale mohou se vyskytovat i spontánně.
Terapie AP zahrnuje jednak sekundárně preventivní opatření s cílem zlepšení prognózy u všech pacientů s ICHS, jednak léčbu symptomatickou, která má zlepšit kvalitu života úlevou od potíží. Mezi léčebná opatření patří úprava životního stylu, farmakoterapie, revaskularizace (chirurgická nebo katetrizační). Doporučené postupy odborných společností v léčbě stabilních forem ICHS v posledních letech zdůrazňují na prvním místě význam preventivních opatření a medikamentózní léčby. Revaskularizace má být vyhrazena pro pacienty výrazně symptomatické, zejména při selhání farmakoterapie, a pro pacienty s prognosticky významným koronárním nálezem [1].
Prognostická stratifikace
Informace o přirozené prognóze pacientů se stabilní AP můžeme čerpat z dat z klinických studií nebo registrů, ačkoli tyto údaje jsou částečně zkresleny výběrem studované populace. Roční mortalita se pohybuje v rozmezí 1,2– 2,4 %, výskyt infarktu myokardu (IM) mezi 0,6 a 1,4 % a náhlé smrti mezi 0,6 a 2,7 % [2,3]. Nicméně prognóza jednotlivých podskupin pacientů se může výrazně lišit v závislosti na mnoha parametrech. V registru REACH byla ve vysokorizikové populaci roční mortalita 3,8 % [4]. Stanovení prognózy je proto důležitou součástí péče o pacienty s AP. Umožňuje identifikovat pacienty s pokročilými formami ICHS a rozsáhlým koronárním nálezem, kteří budou profitovat z intenzivnější léčby, zejména revaskularizace. Na druhou stranu u pacientů s lehčími formami nemoci a dobrou prognózou je možné se vyhnout zbytečně složitým vyšetřovacím postupům a invazivním výkonům.
Evropská kardiologická společnost (ESC) doporučuje pro hodnocení vysokého rizika parametr celkové roční mortality s hodnotou 3 % a více. V pásmu středního rizika je pak populace s roční mortalitou 1– 3 %, zatímco riziko pacientů s roční mortalitou < 1 % je hodnoceno jako nízké, blížící se obecné populaci. Cílem diagnostického postupu v rámci prognostické stratifikace je tedy identifikace populace pacientů, u kterých vysoké riziko přetrvává i přes adekvátní medikamentózní léčbu, a u kterých je tedy možné očekávat prognostický benefit z revaskularizace. U těchto pacientů je pak doporučeno provedení koronarografie a dle anatomického nálezu buď perkutánní koronární intervence (PCI), nebo chirurgické revaskularizace myokardu (CABG) (obr. 1).

Prognózu pacientů se stabilní ICHS je možné stratifikovat zejména dle klinických parametrů, funkce levé komory, zátěžové ischemie a rozsahu koronárního postižení [1].
Klinické parametry
Už na základě anamnézy a fyzikálního vyšetření je možné upřesnit prognózu pacienta s AP. Samotná přítomnost konvenčních rizikových faktorů (diabetes, hypertenze, kouření, hypercholesterolemie) dále zvyšuje riziko u pacientů s diagnostikovanou ICHS. Dalšími důležitými prognostickými faktory jsou věk, chronické onemocnění ledvin, extrakardiální ateroskleróza, anamnéza IM a příznaky srdeční insuficience. Některé práce prokázaly závislost prognózy na závažnosti anginózních symptomů [5]. Nicméně tyto parametry je velmi obtížné zakomponovat do jednotného skórovacího systému. Proto je pro prognostickou stratifikaci vhodné využít echokardiografii a zátěžové testy.
Funkce levé komory
Funkce levé komory je velmi silným prognostickým parametrem. Se snižující se systolickou funkcí se zhoršuje prognóza, jak bylo demonstrováno v registru CASS [6]. Již pacient s ejekční frakcí (EF) levé komory < 50 % má vysoké riziko kardiovaskulárního úmrtí (> 3 %) bez závislosti na dalších rizicích. Proto je v současné době doporučeno provést klidové echokardiografické vyšetření ke stanovení funkce levé komory u všech pacientů se suspekcí na ICHS [1].
Zátěžová ischemie
Jednou z možností, jak diagnostikovat ischemii myokardu, je zátěžová echokardiografie. Tato metoda spočívá v průkazu zátěží vyvolané regionální poruchy kinetiky myokardu levé komory. Inducibilní porucha kinetiky tří a více ze 17 segmentů standardního modelu levé komory je spojena s vysokým kardiovaskulárním rizikem, které odpovídá roční mortalitě > 3 %. Naopak negativní test při vstupní normální funkci levé komory je spojen s výbornou prognózou.
Zátěžová scintigrafie prokazuje ischemii pomocí detekce zátěží vyvolané poruchy perfuze jednotlivých částí myokardu. Zátěžová hypoperfuze > 10 % myokardu levé komory (≥ 2 ze 17 segmentů) je spojena s vysokým rizikem. Normální perfuze myokardu při zátěži indikuje dobrou prognózu s rizikem kardiovaskulárního úmrtí a IM < 1 % [7]. Relativně novou a zatím omezeně dostupnou modalitou je zátěžová magnetická rezonance srdce (MRI). Kromě vysoké senzitivity i specificity je její výhodou možnost detekce jak zátěžové perfuze, tak zátěžové poruchy kinetiky. Kritéria pro prognostickou stratifikaci odpovídají echo‑ a scintigrafii [1].
Koronární postižení
Vliv rozsahu koronárního postižení je dalším důležitým prognostickým ukazatelem u pacientů s AP [8,9]. Ve snaze o prognostickou stratifikaci bylo navrženo několik systémů. Nejčastěji se dnes v praxi používá dělení koronárního postižení na nemoc jedné tepny, dvou tepen, tří tepen, event. stenózu kmene. V registru CASS i dalších studiích byla prokázána špatná prognóza konzervativní léčby zejména u stenózy kmene nebo proximální RIA a nemoci tří tepen [6,10]. Nicméně konzervativní léčba v době těchto prací nesplňovala dnešní doporučení. U prognosticky významného nálezu je doporučována revaskularizace (obr. 2).

Farmakoterapie ovlivňující prognózu
Cílem medikace v rámci sekundární prevence u ICHS je zlepšit prognózu pacienta, tedy redukovat výskyt kardiovaskulárních příhod a snížit celkovou mortalitu.
Antiagregační léčba
Antiagregancia potlačují agregaci trombocytů, a snižují tak riziko vytvoření koronárního trombu. Profylaktická antiagregační léčba je tak standardní součástí sekundární prevence u všech pacientů s diagnostikovanou ICHS. Lékem volby je aspirin blokující destičkový enzym cyklooxygenázu‑ 1 v denní dávce 75– 150 mg, u nás nejčastěji 100 mg. Thienopyridiny a další P2Y12 inhibitory, zejména clopidogrel, ticagrelor a prasugrel, snižují agregaci destiček blokádou destičkového ADP‑ receptoru P2Y12. Clopidogrel představuje u pacientů se stabilní ICHS lék druhé volby při intoleranci nebo kontraindikaci aspirinu. Ticagrelor a prasugrel jsou účinnější v redukci kardiovaskulárních příhod u pacientů po akutním koronárním syndromu [11,12]. Nejsou však údaje o jejich efektu u pacientů se stabilní ICHS.
Hypolipidemická léčba
Všichni pacienti s prokázanou ICHS mají být léčeni statiny, které jsou nejúčinnější v dosažení cílových hodnot lipidogramu. Léčba statiny je spojena s redukcí kardiovaskulární mortality, u vysokých dávek atorvastatinu a rosuvastatinu byla pozorována i regrese aterosklerotických plátů. Kromě efektu daného redukcí hladiny LDL cholesterolu se předpokládá i přímý pozitivní účinek na funkci endotelu a stabilizaci aterosklerotických plátů.
Při nemožnosti dosáhnout cílových hodnot monoterapií statinem, lze zvážit kombinaci statinu s ezetimibem.
ACE inhibitory, sartany
ACE inhibitory (ACEI) a sartany ovliňují hyperaktivovanou osu renin‑angiotenzin‑aldosteron s výsledným snížením krevního tlaku a pozitivním efektem na funkci endotelu. Jejich příznivý vliv na prognózu pacientů s ICHS je nejvíce patrný při současné přítomnosti hypertenze, diabetu, dysfunkce levé komory, srdečního selhání nebo renálního postižení s proteinurií. U stabilní ICHS bez dysfunkce levé komory byl příznivý efekt prokázán pro ramipril, perindopril a telmisartan [13– 15].
Betablokátory
Mechanizmus účinku betablokátorů u ICHS je komplexní. Zpomalují tepovou frekvenci, snižují krevní tlak, zvyšují fibrilační práh, což vede k redukci výskytu ischemie. Betablokátory snižují výskyt recidivy IM a kardiovaskulárního úmrtí o 30 %. Předpokládá se i příznivý vliv na prognózu u pacientů se stabilní ICHS, ačkoli průkaz prognostického významu betablokátorů u AP nebyl testován žádnou randomizovanou studií. Vzhledem ke komplexnímu příznivému účinku betablokátorů, včetně antianginózního, je doporučeno jejich podávání všem pacientům s AP při absenci kontraindikací. V léčbě preferujeme kardioselektivní preparáty pro nižší výskyt nežádoucích účinků. V dávkování je vhodné se orientovat podle tepové frekvence, kdy optimální hodnoty jsou mezi 50 a 60/ min.
Symptomatická léčba
Léky k ovlivnění symptomů můžeme zhruba rozdělit do tří skupin dle mechanizmu účinku na léky bradykardizující, vazodilatancia a metabolické modulátory.
Bradykardizující léčba
Nejvýznamnější skupinou mezi bradykardizujícími preparáty jsou betablokátory. Betablokátory snížením tepové frekvence a prodloužením diastolické fáze zlepšují perfuzi myokardu. Kromě toho negativně inotropním působením snižují spotřebu kyslíku v myokardu. Mají proto velmi silný antianginózní účinek a vzhledem k jejich předpokládanému příznivému vlivu na prognózu jsou v léčbě AP léky první volby u všech pacientů, kteří tuto léčbu tolerují. Alternativou betablokátorů je ivabradin, inhibitor sinusového uzlu (blokátor If kanálů), který zpomaluje spontánní depolarizaci buněk sinusového uzlu, a zpomaluje tak i tepovou frekvenci a snižuje nároky na kyslík bez negativního vlivu na inotropní stav a krevní tlak. Při intoleranci nebo kontraindikaci betablokátorů může být ivabradin použit jako jejich alternativa nebo je možné podávat oba léky současně v případě, že betablokátory nemají dostatečný efekt na tepovou frekvenci. Ve studii BEAUTIFUL ivabradin příznivě ovlivnil prognózu u pacientů s klidovou tepovou frekvencí > 70/ min [16]. Podmínkou použití ivabradinu je zachovaný sinusový rytmus. Další možností jsou bradykardizující blokátory kalciových kanálů – verapamil a dilthiazem. Negativně chronotropní účinek je u nich nižší než u betablokátorů, ale mají i vazodilatační účinek. Jsou proto vhodné u hypertenze a k prevenci vazospasmů. Neměli by být kombinovány s betablokátory pro riziko bradykardie a poruch atrioventrikulárního převodu.
Vazodilatační léčba
Vazodilatancia jsou skupinou antianginózních léků, které způsobují relaxaci epikardiálních věnčitých tepen. Nejstaršími léky v této skupině jsou nitráty. Nitráty (a jiné donátory oxidu dusnatého – NO) navozují vazodilataci zejména v oblasti systémových žil a epikardiálních věnčitých tepen. Jejich účinek je podmíněn konverzí organického nitrátu na NO za účasti látek se sulfhydrylovou skupinou. Při jejich vyčerpání dochází k navození tolerance – snížení odpovědi na nitráty, což je třeba zohledňovat v dávkovacím schématu. K prevenci antianginózních záchvatů se používá izosorbitmononitrát (ISMN) a izosorbitdinitrát (ISDN). Rychle působící nitráty (ISDN a nitroglycerin) se používají v sublinguální formě jako léčba anginózního záchvatu nebo k jeho prevenci v případě, že je ataka AP předpokládána (před fyzickou zátěží). V rámci chronické medikace jsou k prevenci AP používány retardované formy ISDN a ISMN. Výhodou retardovaných nitrátů je malý efekt na systémový tlak, a je tak možné je bezpečně použít i u pacientů se sklonem k hypotenzi. Molsidomin je přímý donátor NO. Má obdobný antianginózní účinek jako nitráty, ale obvykle u něj nedochází ke vzniku tolerance. Retardovaná forma molsidominu je výhodná k pokrytí delší části dne včetně prevence nočních záchvatů AP.
Nicorandil je relativně nový preparát s dvojím mechanizmem účinku. Kromě efektu mechanizmem nitrátů působí vazodilatačně i cestou blokády draslíkových kanálů (KATP kanál). Ve velké studii IONA došlo při terapii nicorandilem k redukci kardiovaskulárního rizika, zatímco vliv na potíže paradoxně prokázán nebyl [17]. Nicorandil u nás dosud nebyl registrován.
Další skupinou vazodilatancií s antianginózním efektem jsou kalciové blokátory dihydropyridinového typu. U nás jsou z této skupiny registrovány amlodipin a felodipin. Vyznačují se cévní selektivitou bez významnějšího vlivu na kontraktilitu myokardu či atrioventrikulární převod. Je tedy možné je použít i u dysfunkce levé komory a v kombinaci s betablokátory. Výhodné jsou i jako součást antihypertenzní terapie.
Modulátory metabolizmu
Poslední skupina antianginózních léků jsou modulátory metabolizmu, z nichž delší dobu je u nás používán jen trimetazidin. Jeho mechanizmus účinku spočívá v potlačení β‑ oxidace mastných kyselin a podpoře syntézy makroergních fosfátů anaerobní glykolýzou, čímž se snižuje spotřeba kyslíku. Jeho výhodou je, že nemá vliv na hemodynamiku ani srdeční frekvenci, a je tak vhodným lékem i u pacientů se sklonem k hypotenzi a bradykardii. Používá se v retardované formě v dávce 2 × 35 mg.
V několika studiích byl u AP prokázán i pozitivní efekt ranolazinu, který blokádou pozdního sodíkového kanálu brání zvýšení sarkoplazmatické koncentrace kalcia, a snižuje tak negativní dopad ischemie na myokard. Ranolazin vedl ke snížení výskytu anginózních atak. U nás zatím není registrován [18– 20].
Allopurinol je inhibitor xantinoxidázy, který je používán ke snížení urikemie u pacientů s dnou. U allopurinolu byl pozorován i účinek antianginózní, avšak spíše na menších souborech při užití dávky kolem 600 mg, která zejména u renální insuficience může vyvolat toxické nežádoucí účinky [21]. Allopurinol v léčbě AP rutinně využíván není.
Refrakterní AP
Jako refrakterní AP označujeme chronický stav charakterizovaný recidivujícími atakami reverzibilní ischemie provázenými významně limitující anginózní bolestí, kterou se nedaří účinně potlačit ani při maximální farmakoterapii a vyčerpání možností katetrizační a chirurgické revaskularizace. Péče o pacienta s refrakterní AP je specifická a multidisciplinární. Bylo zkoušeno mnoho nefarmakologických postupů, z nichž řada byla opuštěna.
U nás dostupná míšní stimulace spočívá v zavedení elektrody do epidurálního prostoru. Elektroda umožňuje vznik parestezií v oblasti vyzařování anginózní bolesti, která je na úrovni míchy potlačována aktivací inhibičních interneuronů. Některé studie prokázaly účinnost míšní stimulace ve smyslu zlepšení tolerance námahy, kvality života i trend v redukci ischemie [22].
Zevní kontrapulzace (enhanced external counterpulsation – EECP) spočívá v aplikaci tří párů nafukovacích manžet na dolní končetiny a jejich periodickém nafukování a vyfukování synchronizovaně se srdečním rytmem. Cílem je zvýšení žilního návratu, snížení afterloadu a zlepšení koronární perfuze. V několika studiích byla pozorována efektivita EECP na zlepšení tolerance námahy a kvality života [23].
Transmyokardiální laserová revaskularizace svou účinnost nepotvrdila.
Strategie léčby AP
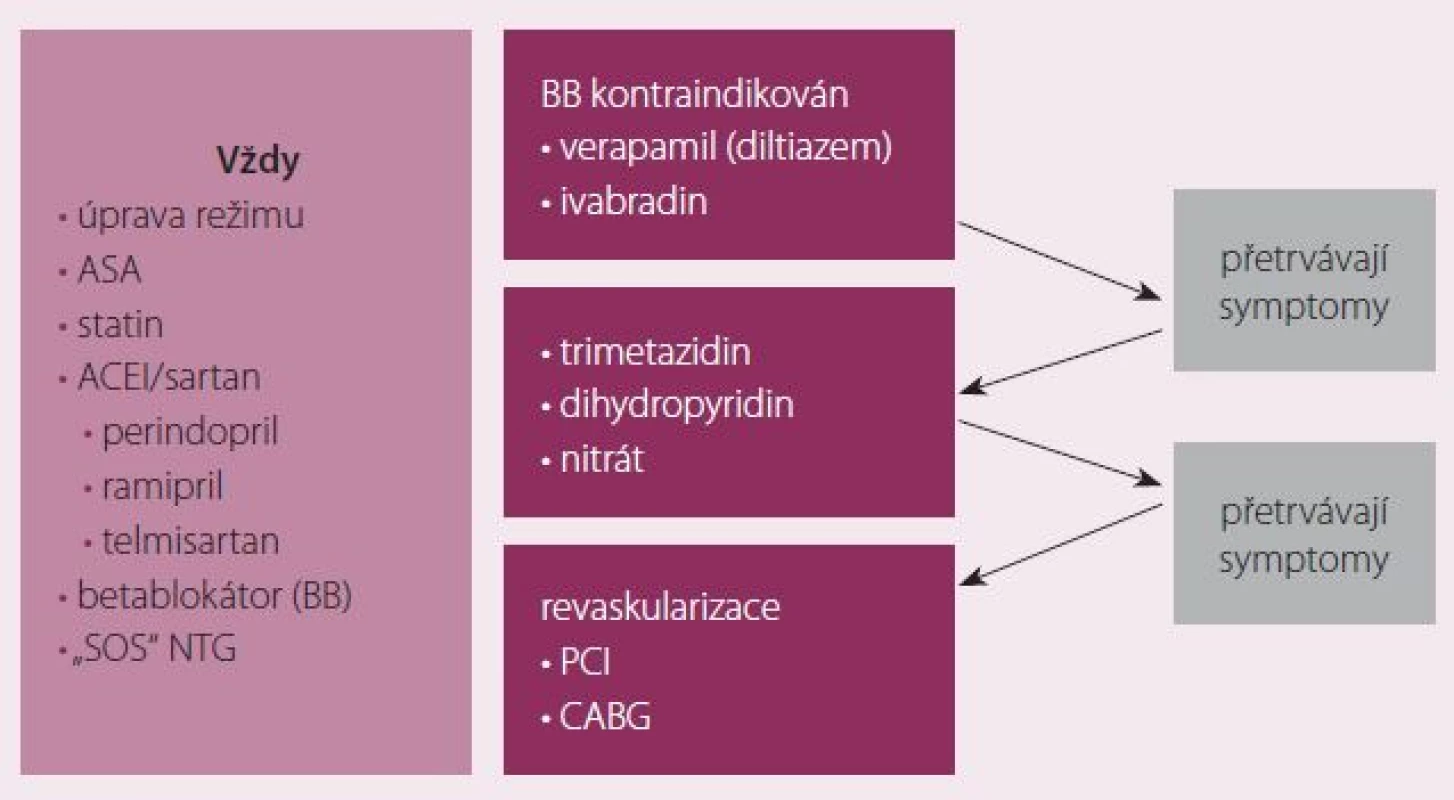
Léčba AP zahrnuje příslušná režimová a dietní opatření, farmakoterapii cílenou na pozitivní ovlivnění prognózy a symptomů a revaskularizaci. Do léčby ovlivňující prognózu patří antiagregancia, statiny, ACEI a betablokátory. Základem symptomatické léčby jsou betablokátory a rychle působící nitrát v sublinguální formě pro akutní potřebu. Při kontraindikaci betablokátorů volíme ivabradin nebo bradykardizující kalciové blokátory. Při přetrvávání symptomů by měl být přidán do kombinace další preparát (trimetazidin nebo vazodilatans). Při významně limitujících symptomech na dvojkombinaci je možné zkusit efekt přidání třetího preparátu do kombinace, často je však zvoleno provedení koronarografie a případně revaskularizace. Revaskularizace je tak vyhrazena pro pacienty symptomatické i na adekvátní farmakoterapii a pro pacienty s vysokým kardiovaskulárním rizikem. Stanovení rizika má být proto součástí péče o každého pacienta s AP (obr. 3).
Práce byla podpořena výzkumným záměrem Nemocnice Na Homolce č. 140504.
Doručeno do redakce: 3. 7. 2015
Přijato po recenzi: 3. 8. 2015
MU Dr. Karel Kopřiva
www.homolka.cz
karel.kopriva@homolka.cz
Zdroje
1. Montalescot G, Sechtem U, Achenbach S et al.2013 ESC guidelines on the management of stable coronary artery disease The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34: 2949– 3003. doi: 10.1093/ eurheartj/ eht296.
2. Henderson RA, Pocock SJ, Clayton TC et al. Seven‑year outcome in the RITA‑ 2 trial: coronary angioplasty versus medical therapy. J Am Coll Cardiol 2003; 42: 1161– 1170.
3. Boden WE, O’Rourke RA, Teo KK et al. Optimal medical therapy with or without PCI for stable coronary disease. N Eng J Med 2007; 356: 1503– 1516.
4. Steg PG, Bhatt DL, Wilson PW et al. One‑year cardiovascular event. rates in outpatients with atherothrombosis. JAMA 2007; 297: 1197– 1206.
5. Mozaffarian D, Bryson CL, Spertus JA et al. Anginal symptoms consistently predict total mortality among outpatients with coronary artery disease. Am Heart J 2003; 146: 1015– 1022.
6. Emond M, Mock MB, Davis KB et al. Long‑term survival of medically treated patients in the Coronary Artery Surgery Study (CASS) Registry. Circulation 1994; 90: 2645– 2657.
7. Brown KA. Prognostic value of thallium‑ 201 myocardial perfusion imaging. A diagnostic tool comes of age. Circulation 1991; 83: 363– 381.
8. Hammermeister KE, DeRouen TA, Dodge HT. Variables predictive of survival in patients with coronary disease. Selection by univariate and multivariate analyses from the clinical, electrocardiographic, exercise, arteriographic, and quantitative angiographic evaluations. Circulation 1979; 59: 421– 430.
9. Mark DB, Nelson CL, Califf RM et al. Continuing evolution of therapy for coronary artery disease. Initial results from the era of coronary angioplasty. Circulation 1994; 89: 2015– 2025.
10. Califf RM, Armstrong PW, Carver JR et al. 27th Bethesda Conference: matching the intensity of risk factor management with the hazard for coronary disease events. Task Force 5. Stratification of patients into high, medium and low risk subgroups for purposes of risk factor management. J Am Coll Cardiol 1996; 27: 1007– 1019.
11. Gurbel PA, Bliden KP, Butler K et al. Randomized double‑blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: theONSET/ OFFSET study. Circulation 2009; 120: 2577– 2585. doi: 10.1161/ CIRCULATIONAHA.109.912550.
12. Jernberg T, Payne CD, Winters KJ et al. Prasugrel achieves greater inhibition of platelet aggregation and a lower rate of non‑responders compared with clopidogrel in aspirin‑treated patients with stable coronary artery disease. Eur Heart J 2006; 27: 1166– 1173.
13. Yusuf S, Sleight P, Pogue J et al. Effects of an angiotensin‑converting enzyme inhibitor, ramipril, on cardiovascular events in high‑risk patients. The Heart Outcomes Prevention Evaluation Study investigators. N Engl J Med 2000; 342: 145– 153.
14. Fox KM. The EUROPA Executive Committee. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: a randomised, double‑blind, placebo‑ controlled, multicentre trial (the EUROPA study). Lancet 2003; 362: 782– 788.
15. Yusuf S, Teo KK, Pogue J et al. The ONTARGET Investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008; 358: 1547– 1559. doi: 10.1056/ NEJMoa0801317.
16. Fox KM, Ford I, Steg G et al. Relationship between ivabradine treatment and cardiovascular outcomes in patients with stable coronary artery disease and left ventricular systolic dysfunction with limiting angina: a subgroup analysis of the randomized, controlled BEAUTIFUL trial. Eur Heart J 2009; 30: 2337– 2345. doi: 10.1093/ eurheartj/ ehp358.
17. Izumiya Y, Kojima S, Kojima S et al. Long‑term use of oral nicorandil stabilizes coronary plaque in patients with stable angina pectoris. Atherosclerosis 2011; 214: 415– 421. doi: 10.1016/ j.atherosclerosis.2010.11.032.
18. Morrow DA, Scirica BM, Chaitman BR et al. Evaluation of the glycometabolic effects of ranolazine in patients with and without diabetes mellitus in the MERLIN‑ TIMI 36 randomized controlled trial. Circulation 2009; 119: 2032– 2039. doi: 10.1161/ CIRCULATIONAHA.107.763912.
19. Wilson SR, Scirica BM, Braunwald E et al. Efficacy of ranolazine in patients with chronic angina observations from the randomized, double‑blind, placebo controlled MERLIN‑ TIMI (Metabolic Efficiency With Ranolazine for Less Ischemia in Non‑ ST‑Segment Elevation Acute Coronary Syndromes) 36 Trial. J Am Coll Cardiol 2009; 53: 1510– 1516. doi: 10.1016/ j.jacc.2009.01.037.
20. Kosiborod M, Arnold SV, Spertus JA et al. Evaluation of ranolazine in patients with type 2 diabetes mellitus and chronic stable angina. results from the TERISA randomized clinical trial. J Am Coll Cardiol 2013; 61: 2038– 2045. doi: 10.1016/ j.jacc.2013.02.011.
21. Noman A, Ang DS, Ogston S et al. Effect of high‑dose allopurinol on exercise in patients with chronic stable angina: a randomised, placebo controlled crossover trial. Lancet 2010; 375: 2161– 2167. doi: 10.1016/ S0140- 6736(10)60391- 1.
22. Andrell P, Yu W, Gersbach P et al. Long‑term effects of spinal cord stimulation on angina symptoms and quality of life in patients with refractory angina pectoris: results from the European Angina Registry Link Study (EARL). Heart 2010; 96: 1132– 1136. doi: 10.1136/ hrt.2009.177188.
23. Arora RR, Chou TM, Jain D et al. The multicenter study of enhanced external counterpulsation (MUST‑EECP): effect of EECP on exercise‑induced myocardial ischemia and anginal episodes. J Am Coll Cardiol 1999; 33: 1833– 1840.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2015 Číslo 3
Nejčtenější v tomto čísle
- Srdeční zástava a poresuscitační péče
- Léčebné postupy u námahové anginy pectoris
- Bezdrátová kardiostimulace – budoucnost nebo fikce?
- Novinka v intervenční terapii srdečního selhání se zachovalou ejekční frakcí levé komory
