Infekční endokarditida
Infective Endocarditis
Infective endocarditis is an inflammatory heart disease which affects the endocardium, as well as artificial prosthetic materials within the heart cavities. The disease remains one of the most serious infectious diseases due to changes in its clinical course and microbial etiology in an era which has seen an increase in the use of artificial implants. Classifying infective endocarditis according to the type of condition and epidemiology factors is important for the correct choice of initial empirical treatment and subsequent treatment strategy. A targeted antibiotic regimen is then determined on the basis of identification of the causative agent. The most frequent agents affecting the endocardium include Staphylococcus aureus and the viridans streptococci. The diagnosis of infective endocarditis is based on microbiological findings, along with imaging methods, especially echocardiography, which demonstrate the presence of the infection within the heart cavities. The treatment of infective endocarditis requires a comprehensive approach in close interdisciplinary collaboration and should be provided in cooperation with Endocarditis Teams in specialised centres. The prevention of infective endocarditis includes basic sanitary measures applied across the whole population to prevent bacteraemia combined with antibiotic prophylaxis administered in a small group of high-risk individuals.
Keywords:
endocarditis – valve disease – echocardiography – infection
Autoři:
M. Tesák 1,2; J. Pařenica 1,3; E. Míšková 2
Působiště autorů:
Interní kardiologická klinika FN Brno
1; Interní oddělení, Nemocnice Třebíč
2; Lékařská fakulta MU Brno
3
Vyšlo v časopise:
Kardiol Rev Int Med 2017, 19(3): 177-182
Souhrn
Infekční endokarditida je zánětlivé onemocnění srdce postihující endokard chlopní, ale i umělé materiály implantované v srdečních dutinách. Onemocnění stále patří mezi nejzávažnější infekční choroby, jejichž problematika nabývá na významu kvůli změně spektra původců i klinického průběhu v souvislosti s přibývajícím počtem umělých srdečních implantátů v populaci. Dělení infekční endokarditidy dle typu postižení a epidemiologických souvislostí je důležité pro volbu správné iniciální empirické léčby i další léčebnou strategii. Cílenou antibiotickou terapii pak upřesňuje identifikace původce onemocnění, přičemž mezi ta nejčastější agens patří Staphylococcus aureus a viridující streptokoky. K diagnóze onemocnění spolu s průkazem přítomnosti patogenu v krvi slouží průkaz přítomnosti infekce v srdečních dutinách zobrazovacími metodami, především echokardiograficky. Léčba nezbytně vyžaduje komplexní přístup s úzkou mezioborovou spoluprací, měla by být navázána na komplexní centra disponující tzv. Endocarditis teamem. Prevence infekční endokarditidy zahrnuje základní hygienická opatření k předcházení bakteriemie aplikovaná na celou populaci a antibiotickou profylaxi aplikovanou na úzkou skupinu vysoce rizikových osob.
Klíčová slova:
endokarditida – onemocnění chlopní – echokardiografie – infekce
Úvod
Infekční endokarditida (IE) je závažné zánětlivé onemocnění srdce infekční etiologie zatížené i v dnešní době mortalitou pohybující se ve vyspělých zemích okolo 15 % [1]. Postižen je nejčastěji endokard chlopní, ale za endokarditidu je pokládán i zánět vyvolaný infikovaným cizím tělesem v srdečních oddílech. Častá je endokarditida chlopenních protéz a rovněž incidence endokarditidy mezi nositeli implantovaných kardiostimulačních systémů a defibrilátorů je vyšší [2,3]. Právě v souvislosti s rozvojem implantabilních přístrojů a katetrizačními intervencemi na srdečních chlopních i přepážkách dochází ke změně klinického průběhu i terapeutických přístupů k tomuto onemocnění, které proto zůstává v centru pozornosti kardiologů i infektologů. V poslední době došlo i k významnému posunu v interdisciplinárním přístupu k onemocnění s cílem dále snížit úmrtnost na IE [4].
Ještě v roce 2009 vydaná Evropská doporučení pro prevenci, diagnostiku a léčbu IE dělila onemocnění podle typu postižení a dle epidemiologických souvislostí [5]. Toto dělení lze pokládat za užitečné i v dnešní době, významně napomáhá při rozhodování o způsobu léčby (tab. 1).

Z hlediska léčby jsou důležité pojmy relaps a recidiva choroby. Relaps onemocnění se dostavuje do 6 měsíců od iniciální ataky choroby, je důsledkem nedostatečného vyléčení onemocnění a je definován průkazem stejného původce jako iniciální ataka. Recidiva IE má buď jiného původce, nebo jde o endokarditidu zapříčiněnou týmž původcem, ale vzniklou více než 6 měsíců od prvotní formy choroby. Recidiva tak představuje nové onemocnění u téhož pacienta.
Etiologie
IE může být bakteriální i mykotická. Běžnější je bakteriální endokarditida. IE může vyvolat prakticky kterýkoli mikrob. V našich podmínkách je nejčastějším původcem Staphylococcus aureus [1]. Ovšem vzhledem k širokému spektru chorob vyvolávaných tímto původcem je jeho nález v hemokulturách pro infekční endokarditidu nespecifický. Bakterie označované někdy zkratkou HACEK (Haemophillus, Actinobacillus, Cardiobacterium, Eikenella, Kingella) nejsou kultivačně častým nálezem, jejich význam však spočívá v poměrně vysoké specificitě takového kultivačního nálezu pro IE, což zohledňují modifikovaná Duke kritéria [6]. Právě tito původci však bývají v hemokultuře obtížněji zachytitelní [5]. Zastoupení původců IE v současnosti shrnuje tab. 2 [7].
![Nejčastější původci infekční endokarditidy [7].](https://www.kardiologickarevue.cz/media/cache/resolve/media_object_image_small/media/image/0e6deaa5df826b2a55dd730ffc4ecaca.png)
Velmi vzácně jsou příčinou infekční endokarditidy intracelulární patogeny (Coxiella burnetii, Bartonella, Chlamydia, Tropheryma Whipplei). Onemocnění IE zapříčiněné těmito původci je spojeno s konstantně negativními hemokulturami a k průkazu je nutno využít sérologii nebo metody polymerázové řetězové reakce (polymerase chain reaction – PCR) (přímo z peroperačně odebraného materiálu vegetace). Z mykotických původců jsou nejčastější příčinou IE kvasinky [7].
Pro rozvahu o iniciální volbě terapie je důležitá klasifikace endokarditidy podle typu postižení. Endokarditida narkomanů je asi v 70 % případů způsobena St. aureus, dále také fungálními patogeny (Candida spp.), endokarditida chlopenních protéz a implantovaných přístrojů (kardiostimulátory, defibrilátory) pak St. aureus, ale velmi významný podíl nesou koaguláza-negativní stafylokoky; zde platí, že takový opakovaný nález stejného druhu koaguláza-negativního stafylokoka v hemokultuře u febrilního pacienta s kardiostimulátorem nemusí být nutně kontaminací. Na endokarditidě nativních chlopní se pak podílejí vyšší měrou viridující streptokoky. Ty postihují obvykle předem organicky poškozený chlopenní aparát [7].
V průběhu let, mimo jiné v souvislosti s přibývajícím počtem nositelů implantovaného umělého materiálu v srdci, ale také v souvislosti s antibiotickou léčbou, se formy srdečního postižení endokarditidou mění. Americké práce naznačují navyšování podílů device-related endocarditis a prostetické endokarditidy a naopak relativní pokles výskytu endokarditidy nativních chlopní [8]. Na našem pracovišti v neselektovaném souboru nemocných ze spádové oblasti 130 000 obyvatel mezi lety 2006 a 2014 jsme zjistili podíl endokarditidy postihující nativní chlopeň (NVE) 70 % všech případů IE, v ostatních případech se jednalo o postižení protetické chlopně (16,7 %), přístrojovou endokarditidu (10 %) nebo současné postižení nativní a protetické chlopně (3,3 %).
Klinické projevy
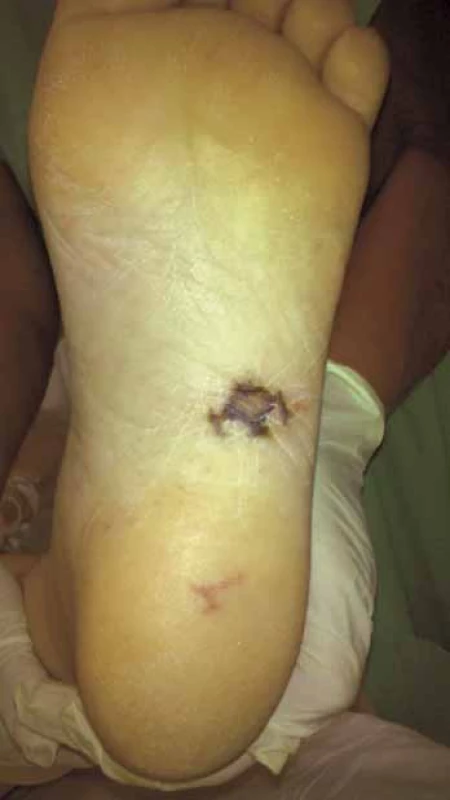
Prvotními důvody kontaktu pacienta se zdravotní péčí jsou nespecifické příznaky, především horečka, dále pak ischemické projevy systémové embolizace (mozková příhoda, infarkt sleziny, ledviny, akutní mezenteriální ischemie apod.) a infekční projevy systémové embolizace (periferní abscesy). U těchto projevů budí podezření na IE především jejich kombinace (horečka ve spojení s novým srdečním šelestem či periferními embolizacemi) nebo netypický charakter (nevysvětlitelné abscesy a jejich neobvyklá lokalizace). Bohužel, většinou až později v průběhu onemocnění bývají zachyceny specifičtější, ale poměrně vzácné příznaky. Spíše u akutních forem IE bývají přítomny Janewayovy léze (nebolestivé nepravidelné tmavé hemoragické makuly, nejčastěji lokalizované na dlaních, ploskách nohou či plantární ploše prstců, trvající dny až týdny). Ke kožním projevům při protrahovaném průběhu IE patří i Oslerovy uzlíky (bolestivé růžové noduly, často s bledým centrem, vyskytující se na prstech rukou či prstcích nohou, výsev je prchavý, trvá hodiny až dny, častěji u „subakutně“ probíhajících endokarditid). Výskyt těchto projevů se odhaduje na asi 2−5 % případů, zatímco v předantibiotické éře se vyskytovaly ve 40– 90 % [9]. Déletrvající endokarditida vede k tvorbě imunokomplexů s následnou imunokomplexovou vaskulitidou, např. ve formě glomerulonefritidy.
Klasické učebnicové rozdělení IE na akutní a subakutní je v klinické praxi velmi zřídkakdy zřejmé. Nejčastější pacient s IE přichází z terénu s protrahovanými febriliemi, jen špatně reagujícími na antibiotickou (ATB) terapii. Obvykle nebývá nalezen jasný zdroj infekce a pacient vykazuje známky těžkého onemocnění s rychle a destruktivně probíhajícím katabolizmem (hypoalbuminemie, vysoké CRP, adynamie).
Je vhodné zmínit častý společný nález spondylodiscitidy a IE, přičemž vzhledem k výrazné klinické symptomatologii (silná bolest) obvykle bývá prvotně diagnostikována a léčena spondylodiscitida. Dle Mylona et al je IE nacházena u 12 % spondylodiscitid [10]. Naopak u 15 % endokarditid lze zjistit spondylodiscitidu [11]. Praktický dopad spočívá především v potřebě zvážit echokardiografické vyšetření u pacientů s prokázanou osteomyelitidou páteře.
Diagnostika
Laboratorně nacházíme jen nespecifický obraz, především elevaci CRP a leukocytózu. Nejdůležitějšími metodami pro stanovení diagnózy jsou echokardiografie (průkaz postižení srdce infekcí) a mikrobiologické vyšetření hemokultur (průkaz původce).
Transthorakální echokardiografie (TTE) je doporučena jako screeningová metoda 1. linie při podezření na IE a má být také vždy zvážena u pacienta s nálezem St. aureus v hemokulturách. Při pozitivním nálezu pak indikujeme transezofageální echokardiografické vyšetření (TEE) s výjimkou jednoznačných nálezů nekomplikované pravostranné endokarditidy dobře vyšetřitelných pacientů. TEE musí být doplněno i při nediagnostickém TTE, při negativním TTE s trvajícím výrazným klinickým podezřením (např. konstantně pozitivní hemokultury s typickým původcem), u chlopenních protéz či kardiostimulačních elektrod. Opakování TTE, případně i TEE s odstupem asi 7 dní je indikováno při negativním nálezu a trvajícím podezření na endokarditidu [4]. Falešně negativní echokardiografické nálezy se totiž popisují asi v 15 % případů [12,13].
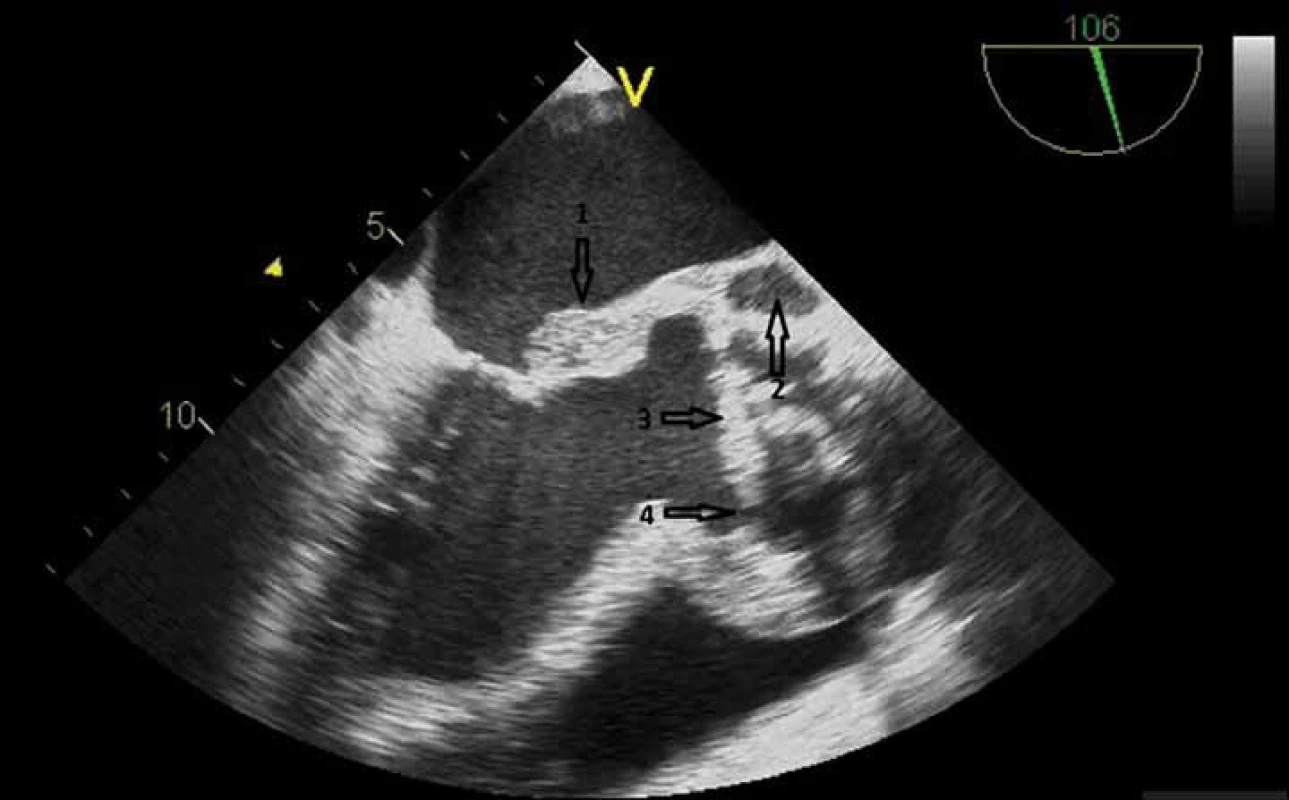
Ultrazvukové vyšetření srdce je v průběhu léčby onemocnění opakováno k posouzení úspěšnosti léčby a zachycení případné progrese onemocnění včetně komplikací indikujících operační řešení (obr. 2).
V posledních letech narůstá v diagnostice IE význam nukleárních metod, konkrétně SPECT/ CT vyšetření značenými leukocyty a PET/ CT. Nadějné jsou tyto metody u prostetické endokarditidy, která může být echokardiograficky obtížněji odhalitelná a Duke kritéria jsou méně senzitivní [14]. Časně po kardiochirurgické operaci je SPECT/ CT značenými leukocyty výtěžnější než PET/ CT pro nespecifické pooperační změny ve vyšetřované oblasti [4]. Obecně platí, že PET/ CT vykazuje vyšší senzitivitu a SPECT/ CT vyšší specificitu a je technicky složitější [15].
Multidetektorová výpočetní tomografie poskytuje komplexnější prostorové informace o rozsahu postižení (abscesy, pseudoaneuryzmata, dehiscence). V praxi je ale více využívána k detekci septických embolizací [4,13].
K záchytu komplikací slouží screeningově EKG (AV blokády), RTG srdce a plic a ultrazvuk břicha (septické embolizace). Pátráme po případném fokusu v těle, který mohl být zdrojem tranzientní bakteriemie s následnou infekcí endokardu (zubní fokusy, paranazální dutiny, střevní divertikly u enterokokových endokarditid aj.). Napovědět může kultivační nález (např. Streptococcus bovis u fokusů v zažívacím traktu).
Hemokultury odebíráme alespoň tři ze tří různých míst, v ideálním případě má být mezi jednotlivými odběry alespoň 30minutový interval a nejméně jedna hemokultura má být anaerobní. Není vhodné odebírat hemokultury z centrální žilní kanyly či arteriálního přístupu, riziko kontaminace a falešně pozitivního nálezu je vysoké. Protože bakteriemie u IE je trvalá, nečekáme na vzestup febrilní [4].
Sérologické vyšetření je vhodné doplnit u IE (prokázané zobrazovacími metodami a klinickým obrazem) s opakovaně negativními hemokulturami. Doporučuje se sérologické vyšetření na následující původce: Coxiella spp., Bartonella spp., Brucella spp., Legionella spp., Aspergillus spp. [16].
Metody PCR jsou využívány u IE s negativními hemokulturami. Doporučeno je využít PCR k detekci původce IE z chirurgického resekátu infikované chlopně nebo periferního embolu. Metodika dosud nebyla plně validována pro diagnostiku z krevních vzorků. Zdá se, že při vyšetření z periferní krve má PCR u kultivovatelných kmenů nižší senzitivitu i specificitu než klasické kultivační metody. Jako atraktivní se jeví především u pacientů s odběrem kultivací až pod ATB clonou a, jak již bylo zmíněno, u nekultivovatelných bakterií (např. Brucella spp.). Problémem metody je především neschopnost odlišit viabilní a neviabilní původce a také náchylnost k falešné pozitivitě při kontaminaci vzorků [5,16].
Imunohistochemie, především fluorescenční in situ hybridizace (FISH), slouží k urychlení identifikace původce (oproti klasickým kultivačním metodám o 1−2 dny) a k identifikaci mikroba přímo v materiálu chlopně získaném při kardiochirurgické operaci [16].
Původně k výzkumným účelům byla vytvořena tzv. Duke kritéria k diagnostice IE. Modifikovaná Duke kritéria jsou využívána i v klinické praxi (tab. 3) [6]. Asi u čtvrtiny pacientů však nelze ani s využitím kritérií diagnózu definitivně potvrdit [12]. Modifikovaná Duke kritéria nemohou a ani nesmějí nahradit klinický úsudek lékaře.

Léčba
Multidisciplinární přístup
Nová doporučení Evropské kardiologické společnosti definují tzv. Endocarditis team jako jedno z nejdůležitějších opatření, která mohou vést k dalšímu snížení mortality na IE. Úzká interdisciplinární spolupráce je naprosto nezbytná k zajištění kvalitního diagnostického a terapeutického managementu. Aby byla týmová spolupráce smysluplná, je třeba dostatečných zkušeností všech členů týmu. Proto by péče o pacienty s IE měla být soustředěna především do větších center disponujících kardiology, kardiochirurgy, infektology, mikrobiology a neurology, ale také vybavených potřebnými zobrazovacími modalitami vč. multidetektorového CT a magnetické rezonance. Endocarditis team by měl být funkční, tzn. měl by se pravidelně scházet a přehodnocovat diagnosticko-terapeutickou strategii u pacientů s IE. Pacienti s nekomplikovanou endokarditidou mohou být iniciálně léčeni mimo velká komplexní centra, avšak Endocarditis team by měl být pravidelně konzultován a v případě komplikací nebo rizik by takový pacient měl být do centra směřován [4].
Antimikrobiální léčba
Všechna doporučení pro diagnostiku a léčbu IE využívají terapeutická schémata s ohledem na původce onemocnění a klasifikaci IE. Vzhledem k velkému rozsahu terapeutických schémat a také dynamickým změnám v doporučených schématech s ohledem na mikrobiologickou situaci a vývoj rezistence odkazujeme v podrobnostech na specializovanou literaturu a aktualizovaná doporučení Evropské kardiologické společnosti v české lokalizaci. Nutno zdůraznit, že při snaze o respektování jakéhokoli terapeutického schématu musíme zohlednit lokální epidemiologickou situaci, znalost bakteriální rezistence v daném čase a místě a také vždy úzce antibiotickou léčbu, ale i indikaci laboratorních odběrů k průkazu patogenu. Vše je třeba konzultovat s ATB střediskem. Kromě volby ATB je stejně důležitá správná indikace případné chirurgické léčby a léčba komplikací [17]. Role Endocarditis teamu je proto nezastupitelná.
Iniciální empirická antibiotická terapie v současnosti rozlišuje dvě skupiny pacientů [4]. První skupinou jsou pacienti s komunitní endokarditidou ve formě NVE nebo pozdní endokarditidy chlopenních protéz (PVE) (tab. 1). U této skupiny je třeba léčbou pokrýt stafylokoky, streptokoky a enterokoky (tab. 2). Doporučena je proto kombinace ampicilinu (12 g/ den) s oxacilinem (12 g/ den) a gentamicinem (3 mg/ kg/ den). U pacientů alergických na penicilin se volí vankomycin (30– 60 mg/ kg/ den) s gentamicinem. Druhou skupinu zahrnují pacienti s časnou PVE a pacienti s endokarditidou spojenou se zdravotní péčí. U těch je iniciální empirickou volbou trojkombinace vankomycin s gentamicinem a rifampicinem (900– 1 200 mg/ den) k pokrytí methicilin-rezistentních stafylokoků a gramnegativních mikroorganizmů. Je vhodné doplnit, že v současnosti je na většině větších pracovišť k dispozici monitorování hladin gentamicinu a vankomycinu a že by mělo být využíváno [18]. Dle našich zkušeností je zejména po první dávce gentamicinu často vrcholová hladina pod terapeutickým oknem, což má za následek nedostatečný účinek ATB při současně zachovalém nefrotoxickém potenciálu gentamicinu. Podrobněji lze stran volby ATB odkázat na literaturu [4] a zejména – vždy by měl být konzultován mikrobiolog a klinický farmaceut, kteří interpretují i stanovené hladiny léků.
Délka terapie je opět multidisciplinárním rozhodnutím. Určuje ji především forma onemocnění, původce a klinická odpověď. Obvykle trvá 4– 6 týdnů od negativních kultivací (nikoli od zahájení terapie), u PVE i déle.
Chirurgická léčba
Rozhodnutí o ní patří do kompetence týmu. Stručně jsou indikace uvedeny v tab. 4 [4,17]. Recentní publikace podporují časnou chirurgickou léčbu pacientů s velkými vegetacemi a významnou chlopenní vadou [19].

Specifické situace
Infekční endokarditida není indikací k zahájení antiagregační ani antikoagulační léčby, taková terapie představuje riziko prokrvácení ischemických kardioembolizačních ložisek v centrálním nervovém systému (CNS). Pacienti warfarinizovaní z důvodu chlopenní protézy samozřejmě antikoagulační léčbu potřebují. V takových případech, pokud je riziko kardioembolizace vysoké (např. stafylokoková endokarditida), je možné zvážit převedení na nefrakcionovaný heparin [20], stejně jako v případě ischemického iktu u antikoagulovaného pacienta s IE. Při velkém krvácení se doporučuje i přerušení chronické antiagregační léčby [4].
Kontroverzní se donedávna jevila kardioembolizační příhoda do CNS s následným kardiochirurgickým zákrokem. Operace v mimotělním oběhu totiž vyžaduje antikoagulaci a ta představuje riziko prokrvácení ischemického ložiska. Tranzitorní ischemická ataka a němá ischemická ložiska zachycená na CT mozku v souvislosti s IE nepředstavují kontraindikaci kardiochirurgické operace, ale naopak podporují úvahy o bezodkladné chirurgické léčbě IE (tab. 4). Ani symptomatický mozkový infarkt (s výjimkou velmi velkých iktů a pacientů v komatu) však sám o sobě pravděpodobně neznamená zásadní zvýšení rizika perioperační mortality. Navíc v práci Ruttmanna et al dochází u 70 % úspěšně operovaných pacientů s ischemickou cévní mozkovou příhodou (CMP) k plnému odeznění neurologického deficitu. Operační zákrok byl v této studii proveden průměrně 4 dny po prodělaném mozkovém infarktu [21]. Oproti tomu výsledky urgentních srdečních operací u pacientů s endokarditidou a recentní hemoragickou mozkovou příhodou jsou špatné [22].
Přístrojová endokarditida vzniklá v souvislosti s implantací kardiostimulátorů či defibrilátorů je obtížněji diagnostikovatelná (TEE má nižší senzitivitu, zejména přehlednost elektrod v pravostranných oddílech je nižší, než je tomu u levostranných srdečních chlopní) a rovněž obtížněji léčitelná. Riziko relapsu či neúspěšné léčby je velmi vysoké, a proto má být vždy zvážena extrakce elektrodového systému a explantace přístroje. Extrakce by měla probíhat preferenčně endovaskulární cestou, kardiochirurgický přístup je spojen s vyšším rizikem komplikací. Není vhodné ani následné zavedení dočasné kardiostimulace ani implantace nového kardiostimulačního systému bezprostředně po extrakci [2].
K nové implantaci (z jiného přístupu, než jaký byl užit pro původní kardiostimulátor) se přistupuje až po zvládnutí infekce ATB léčbou. Pokud je pacient na kardiostimulaci závislý a po explantaci přístroje bez ní zůstat nemůže, lze zvážit aktivní fixaci dočasné elektrody k časné mobilizaci [2,4].
Prevence
V posledních letech došlo k odklonu od profylaktického užívání ATB před invazivními zákroky spojenými s bakteriemií. Naopak je kladen významný důraz na zcela základní nefarmakologická opatření zaměřená na širokou populaci. Ta zahrnují dentální hygienu, důslednou eradikaci infekčních fokusů a minimalizaci zdravotních výkonů spojených s rizikem bakteriemie spolu s dodržováním zásad aseptického ošetřování invazivních vstupů. ATB profylaxe je vyhrazena pouze pro zubní výkony spojené s manipulací s dásní nebo porušením slizniční bariéry, a to jen u pacientů s vysokým rizikem. K těm se řadí nositelé chlopenních náhrad (včetně osob, kterým byla provedena plastika chlopně s využitím prostetického materiálu), pacienti po prodělané IE a konečně osoby s nekorigovanou vrozenou cyanotickou vadou či reziduální vadou po korekci. Chirurgicky či perkutánně léčená vrozená srdeční vada bez reziduálního zkratu či regurgitace je indikována k dočasné profylaxi po dobu 6 měsíců do endotelizace prostetického materálu [4].
Závěr
Problematika IE zasahuje do řady lékařských oborů, doporučené postupy a Evidence-based medicína nemohou postihnout všechny situace tak klinicky variabilního onemocnění spojeného s množstvím možných komplikací. Právě proto je třeba klást v diagnostice i léčbě důraz na multidisciplinární týmový přístup spojený s úzkou spoluprací, dostatečné klinické zkušenosti a především dodržet zásadu profesního „respektu“ k chorobě samotné.
Doručeno do redakce: 12. 9. 2017
Přijato po recenzi: 15. 9. 2017
MU Dr. Martin Tesák
www.nem-tr.cz
mtesak@nem-tr.cz
Zdroje
1. Leone S, Ravasio V, Durante-Mangoni E et al. Epidemiology, characteristics, and outcome of infective endocarditis in Italy: the Italian Study on Endocarditis. Infection 2012; 40(5): 527– 535. doi: 10.1007/ s15010-012-0285-y.
2. Baddour LM, Bettmann MA, Bolger AF et al. Nonvalvular cardiovascular device– related infections. Circulation 2003; 108(16): 2015– 2031. doi: 10.1161/ 01.CIR.0000093201.57771.47.
3. Nery PB, Fernandes R, Nair GM et al. Device-related infection among patients with pace-makers and implantable defibrillators: incidence, risk factors, and consequences. J Cardiovasc Electrophysiol 2010; 21(7): 786– 790. doi: 10.1111/ j.1540-8167.2009.01690.x.
4. Habib G, Lancellotti P, Antunes MJ et al. 2015 ESC Guidelines for the management of infective endocarditis. The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC)Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015; 36(44): 3075– 3128. doi: 10.1093/ eurheartj/ ehv319.
5. Habib G, Hoen B, Tornos P et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009). The Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Eur Heart J 2009; 30(19): 2369– 2413. doi: 10.1093/ eurheartj/ ehp285.
6. Li JS, Sexton DJ, Mick N et al. Proposed Modifications to the Duke Criteria for the Diagnosis of Infective Endocarditis. Clin Infect Dis 2000; 30(4): 633– 638. doi: 10.1086/ 313753.
7. Murdoch DR, Corey GR, Hoen B et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis– Prospective Cohort Study. Arch Intern Med 2009; 169(5): 463– 743. doi: 10.1007/ s10096-002-0798-x.
8. Toyoda N, Chikwe J, Itagaki S et al. Population trends in the incidence, etiology and outcomes of infective endocarditis. Circulation 2016; 134 (Suppl 1): Abstract A20605.
9. Beaulieu A, Rehman HU. Janeway lesions. Can Med Assoc J 2010; 182(10): 1075. doi: 10.1503/ cmaj.091528.
10. Mylona E, Samarkos M, Kakalou E et al. Pyogenic vertebral osteomyelitis: a systematic review of clinical characteristics. Semin Arthritis Rheum 2009; 39(1): 10– 17. doi: 10.1016/ j.semarthrit.2008.03.002.
11. Le Moal GL, Roblot F, Paccalin M et al. Clinical and laboratory characteristics of infective endocarditis when associated with spondylodiscitis. Eur J Clin Microbiol Infect Dis 2002; 21(9): 671– 675. doi: 10.1007/ s10096-002-0798-x.
12. Habib G, Derumeaux G, Avierinos JF et al. Value and limitations of the duke criteria for the diagnosis of infective endocarditis. J Am Coll Cardiol 1999; 33(7): 2023– 2029. doi: 10.1016/ S0735-1097(99)00116-3.
13. Bruun NE, Habib G, Thuny F et al. Cardiac imaging in infectious endocarditis. Eur Heart J 2014; 35(10): 624– 632. doi: 10.1093/ eurheartj/ eht274.
14. Pérez-Vázquez A, Fariñas MC, García-Palomo JD et al. Evaluation of the Duke criteria in 93 episodes of prosthetic valve endocarditis: could sensitivity be improved? Arch Intern Med 2000; 160(8): 1185– 1191. doi: 10.1001/ archinte.160.8.1185.
15. Rouzet F, Chequer R, Benali K et al. Respective performance of 18F-FDG PET and radiolabeled leukocyte scintigraphy for the diagnosis of prosthetic valve endocarditis. J Nucl Med 2014; 55(12): 1980– 1985. doi: 10.2967/ jnumed.114.141895.
16. Moter A, Musci M, Schmiedel D. Molecular methods for diagnosis of infective endocarditis. Curr Infect Dis Rep 2010; 12(4): 244– 252. doi: 10.1007/ s11908-010-0111-6.
17. Tesák M. Infekční endokarditida. In: Ševčík P (ed.) Intenzivní medicína. Praha: Galén 2014: 751– 754.
18. Beneš J, Gregor P, Mokráček A. Infekční endokarditida. Doporučené postupy diagnostiky, léčby, dispenzarizace a profylaxe. Cor Vasa 2007; 49(6): Kardio.
19. Kang DH, Kim YJ, Kim SH et al. Early surgery versus conventional treatment for infective endocarditis. N Engl J Med 2012; 366(26): 2466– 2473. doi: 10.1056/ NEJMoa1112843.
20. Piper C, Körfer R, Horstkotte D. Prosthetic valve endocarditis. Heart 2001; 85(5): 590– 593. doi: 10.1136/ heart.85.5.590.
21. Ruttmann E, Willeit J, Ulmer H et al. Neurological outcome of septic cardioembolic stroke after infective endocarditis. Stroke 2006; 37(8): 2094– 2099. doi: 10.1161/ 01.STR.0000229894.28591.3f.
22. Yoshioka D, Sakaguchi T, Yamauchi T et al. Impact of early surgical treatment on postoperative neurologic outcome for active infective endocarditis complicated by cerebral infarction. Ann Thorac Surg 2012; 94(2): 489– 496. doi: 10.1016/ j.athoracsur.2012.04.027.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2017 Číslo 3
Nejčtenější v tomto čísle
- Stratifikace kardiovaskulárního rizika a nové cílové hodnoty sérových lipidů
- SGLT2 (glifloziny) antidiabetika, antihypertenziva nebo léky na srdeční selhání?
- Statinová intolerance a její praktická řešení
- Infekční endokarditida