Nové možnosti farmakoterapie diabetu
New pharmacotherapy of diabetes
The article presents an overview of current and prospective pharmacological therapy of diabetes mellitus. New pathophysiological findings over the last decade have instigated efforts to find drugs that would be able to positively affect the newly discovered abnormalities in glucose metabolism and contribute to its impact on the treatment of diabetes. Some of these drugs, such as inhibitors of dipeptidyl peptidase 4 (DPP‑ 4) or glucagon‑like peptide 1 (GLP‑1) agonists, have been used successfully, and the others are waiting to be launched (SGLT‑ 2 inhibitor – dapagliflozin) or are undergoing different stages of clinical testing.
Keywords:
diabetes mellitus – antidiabetics – pharmacotherapy
Autoři:
T. Edelsberger
Působiště autorů:
Diabetologická ambulance, Krnov
Vyšlo v časopise:
Kardiol Rev Int Med 2014, 16(2): 138-142
Kategorie:
Interní medicína
Souhrn
Článek přináší aktuální přehled o současných a perspektivních možnostech farmakologické léčby diabetes mellitus. Nové patofyziologické poznatky z posledních desetiletí podnítily snahy o nalezení farmak, která by byla schopny příznivě ovlivnit nově objevené abnormality glukózového metabolizmu a podílet se svým působením na terapii diabetu. Některé z těchto léků jako inhibitory dipeptidylpeptidázy 4 (DPP‑ 4) nebo agonisté glucagon‑like peptidu 1 (GLP‑1) jsou již s úspěchem používány, další z nich čekají na uvedení na trh (inhibitory SGLT‑ 2 glifloziny), případně teprve procházejí stadiem klinického testování.
Klíčová slova:
diabetes mellitus – antidiabetika – farmakoterapie diabetu
Léčit diabetes je na první pohled ohromně snadné. Stačí pouze dosáhnout a udržet normoglykemii. Ve skutečnosti se ovšem problematika léčby diabetu jeví čím dál komplexnější, a to zejména kvůli značné heterogenitě diabetické populace. Pacienti s diabetem se liší věkem, trváním nemoci, somatotypem a v celé velké řadě dalších přidružených faktorů a komorbidit. Z toho plyne, opíraje se o poznatky z nedávných let, zcela zásadní nutnost přizpůsobit léčbu diabetu potřebám konkrétního pacienta. Jinými slovy – co je vhodné pro jednoho, nemusí být to pravé pro jiného. Dalším faktorem přispívajícím k současnému rozvoji antidiabetické terapie patří několik dalších, v posledních letech objevených či spíše znovuobjevených patofyziologických mechanizmů, které upřesňují naše chápání diabetu jakožto nemoci propojující téměř všechny orgánové systémy lidského těla (obr. 1).
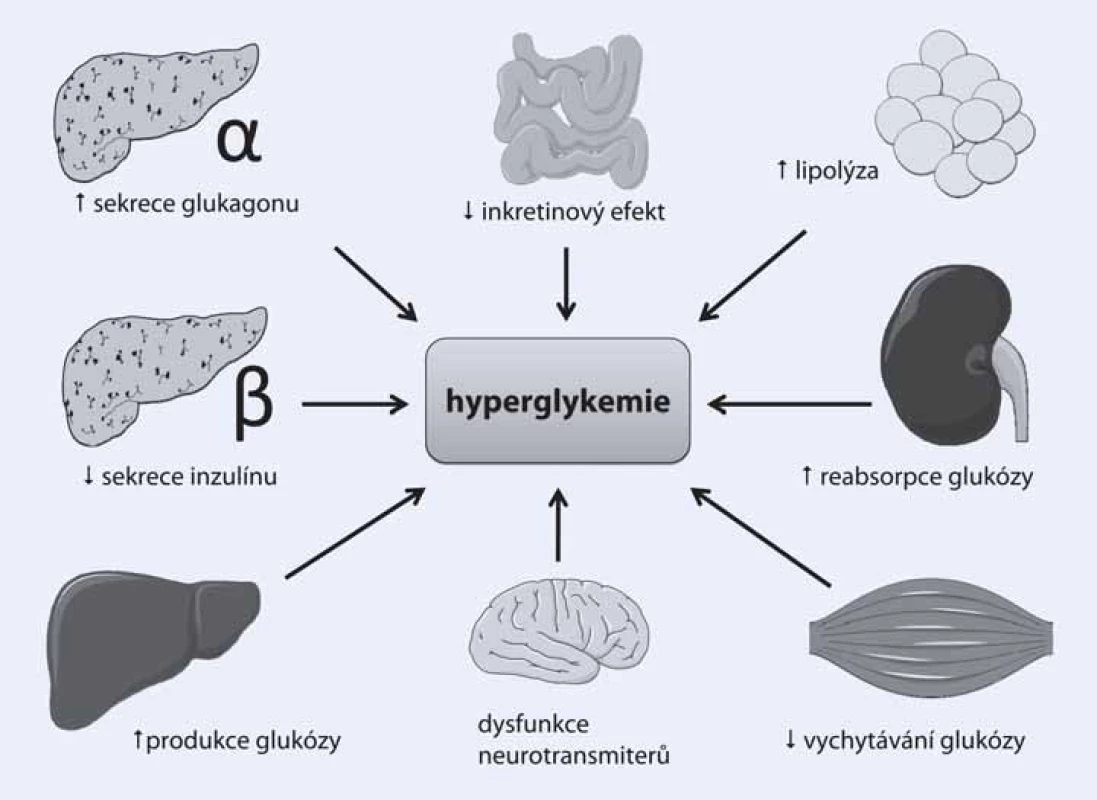
Přestože klíčové postavení patří i nadále porušené sekreci inzulinu v beta‑buňkách pankreatu a jaterní inzulinové rezistenci, klinický obraz diabetu 2. typu by nebyl v takové míře vyjádřen bez dalšího přispění dysbalance tzv. enteroinzulární osy probíhající mezi endokrinně aktivními buňkami v gastrointestinálním traktu a pankreatem (tzv. inkretinový efekt), zvýšené sekrece glukagonu či zvýšené reabsorpce glukózy v ledvinách. Tyto nové patofyziologické dráhy samozřejmě podnítily i snahy o nalezení farmak, která by byla schopna příznivě ovlivnit zmíněné abnormality a přispět svým antidiabetickým efektem k terapii cukrovky. Některé z těchto léků, jako jsou inhibitory dipeptidylpeptidázy 4 (DPP‑ 4) či agonisty glucagonu‑like peptidu 1 (GLP‑1), již s úspěchem používáme v léčbě diabetu i v ČR, další z nich čekají na uvedení na trh (glifloziny) či teprve procházejí stadiem klinického zkoušení.
Novinky v léčbě inzulinem
Na rozdíl od všudypřítomné digitalizace probíhající ve všech odvětvích našeho života prožíváme z hlediska inzulinové léčby spíše dobu „analogovou“. Pokroky v molekulární biochemii a v technologických možnostech průmyslové farmaceutické výroby umožňují upravovat molekuly téměř dle libosti. Umožňují tak i vylepšení jejich léčebných vlastností, v případě inzulinu zejména rychlost a rovnoměrnost vstřebávání. Analoga inzulinu však představují mnohem více než jen důkaz dovednosti farmaceutů, jak si „pohrát“ s molekulou inzulinu. Zvláště pro pacienty s diabetem 1. typu znamenají tyto inzuliny obvykle významné zlepšení kontroly diabetu, ale také kvality života. Krátkodobá analoga (lispro, aspart a glulisin) mnohem přesněji napodobují křivku vylučování vlastního inzulinu, což umožňuje ve srovnání se staršími typy inzulinu účinnější redukci vzestupu krevního cukru po jídle a zároveň větší flexibilitu pacientů s aktivním a nepravidelným způsobem života. Dlouhodobá analoga (glargin, detemir) zase vykazují postupné, stabilnější uvolňování, nižší variabilitu účinku a menší výskyt hypoglykemií.
Přestože zmíněná – a v léčbě diabetu již etablovaná krátce i dlouhodobě působící – analoga inzulinu mají ve srovnání s humánními inzuliny řadu předností, snaží se farmaceutický průmysl o vývoj dalších analog, která by se svými farmakokinetickými a farmakodynamickými vlastnostmi co nejvíce přiblížila k „ideálnímu“ inzulinu. Nejdále v preklinickém, resp. klinickém výzkumu pokročil inzulin degludec, který se může pochlubit velkým množstvím dat ze studií fáze III (program klinických studií BEGIN). Degludec lze vzhledem k profilu účinku skutečně označit za „bezvrcholový“ inzulin zajišťující setrvalý 24hodinový účinek. Při aplikaci jednou denně dochází v průběhu několika dní k ustálené hladině (steady‑ state) degludecu v těle. Biochemicky jde o acylovaný bazální inzulin s protrahovanou absorpcí, která je způsobena formováním multihexamerových řetězců v místě aplikace. Z klinického pohledu bude pravděpodobně největší výhodou redukce nočních hypoglykemií stejně tak jako určitá míra flexibility doby podávání na straně pacienta [2,3].
Dalším dlouhodobě účinkujícím analogem inzulinu je molekula s označením LY2605541. Publikovaná data ze studií fáze II srovnávající LY2605541 s inzulinem glargin prokazují u diabetu 1. i 2. typu nadějné výsledky ve smyslu dosažení glykemické kontroly a redukce hypoglykemických epizod. Komplexní pohled na tento nový bazální analog inzulinu přinesou až výsledky výzkumného programu IMAGINE, který prozatím probíhá. Jedná se o PEGylovaný inzulin lispro – na aminokyselinu lyzin v pozici B28 molekuly inzulinu je kovalentně navázaný polyetylenglykol o velikosti 20 kDa. Tato modifikace, která vede k větší hydrodynamické velikosti molekuly inzulinu LY2605541, zajišťuje prodlouženou absorpci, redukuje clearance z organizmu a zajišťuje 24hodinový účinek při podávání jednou denně. Z hlediska patofyziologického může mít klinický význam zřetelná jaterní orgánová preference účinku této molekuly inzulinu [4– 7].
U krátkodobých analog inzulinu je snahou ještě výraznější urychlení nástupu účinku, který by lépe kopíroval fyziologickou křivku sekrece inzulinu. Zajímavým řešením tohoto problému se jeví současná injekce rekombinantní humánní hyaluronidázy (rHuPH20), která ve studii akcelerovala farmakokinetický i farmakodynamický účinek všech tří krátkodobých analog (lispro, aspart, glulisin) [8].
Nadále se hledají i neinvazivní alternativy k injekčně podávanému inzulinu. Největší naděje se upírají k inhalačně aplikované formě inzulinu. Publikovaná data o inzulinu Technosphere (inhalační prášek) naznačují možnost jeho použití u pacientů s diabetem 2. typu především k ovlivnění postprandiálních hyperglykemií, a to dokonce i u pacientů s astmatem současně užívajících inhalační kortikoidy či betamimetika. Dalším zajímavým zjištěním je příznivý účinek inhalačního inzulinu na hladinu volných mastných kyselin a supresi glukagonu. Perorálně podávaný inzulin ORMD 0801 podávaný ve formě kapslí s použitím speciální technologie usnadňující vstřebávání střevem vstupuje do fáze II klinických studií u pacientů s diabetem 1. i 2. typu [9,10].
Umělá slinivka (arteficiální pankreas)
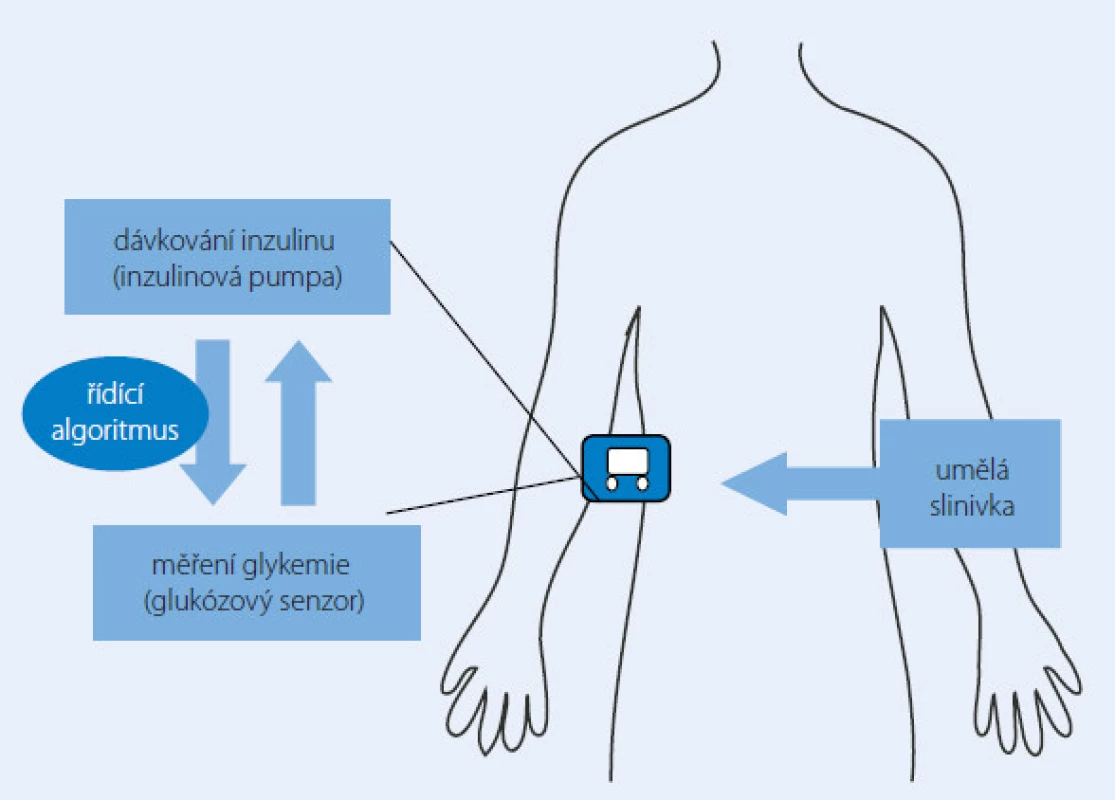
Myšlenka umělé slinivky není vůbec nová. Již v minulém století byl k dispozici přístroj schopný dávkovat inzulin a zároveň analyzovat vnitřní prostředí pacienta zvaný Biostator, který však nebyl kvůli svým rozměrům použitelný pro běžný život. Miniaturizace a moderní technologie dnes nabízí mnohem odolnější a praktičtější přístroje schopné vytvořit základ budoucího umělého pankreatu. Dvě potřebné součásti takové uzavřené smyčky (closed‑ loop) samostatně regulující dodávku inzulinu do těla diabetika 1. typu již máme k dispozici (inzulinová pumpa, resp. kontinuální monitor glykemie). Nejmodernější modely z obou těchto skupin jsou dostatečně výkonné i spolehlivé zároveň, ovšem pouze pod bdělou kontrolou pacienta a/ nebo jeho lékaře. Zdánlivě jednoduchý „třetí element“, tj. algoritmus neboli software řídící a propojující oba přístroje, nebylo lehké vytvořit. Předpokládaná spolehlivost tohoto arteficiálního pankreatu dospěla (alespoň dle rozhodnutí výrobců a zkoušejících) do takového stadia, že začali s umělou slinivkou provádět i klinické studie. Prozatímní výsledky jsou docela slibné, a to při testování arteficiálního pankreatu jak u dospělé, tak i dětské populace (obr. 2) [11,12].
Inkretinová léčba
Jako inkretiny se označují polypeptidické hormony složené z několika desítek aminokyselin s velmi krátkým biologickým poločasem, které se vytvářejí ve stěně trávicího ústrojí v enteroendokrinních K a L buňkách jako reakce na požití potravy. Nejznámějšími a nejvíce prozkoumanými inkretiny jsou glucagon‑like peptid 1 (GLP‑1) a glucose‑dependent insulinotropic polypeptid (GIP), přičemž léčebné využití je prozatím svázáno pouze s prvním z nich. Nejvýznamnější působení inkretinů v lidském těle spočívá v regulaci hladiny krevního cukru – glukózy – ovlivněním sekrece inzulinu ze slinivky břišní. Mezi další funkce inkretinů patří postprandiální (po jídle) potlačení sekrece glukagonu a ovlivnění vyprazdňování žaludku. GLP‑1 prokazatelně zpomaluje vyprazdňování žaludku, zvyšuje citlivost beta‑buněk k sekrečním podnětům, upravuje kvalitu sekrece inzulinu (obnovuje nejrychlejší tzv. první fázi inzulinové sekrece chybějící u osob s diabetem), snižuje sekreci glukagonu, a tím i výdej glukózy hepatocyty, a potlačuje chuť k jídlu. Svým komplexním účinkem tak ovlivňuje postprandiální glykemii i glykemii nalačno. Hladiny GLP‑1 v krvi nalačno jsou relativně nízké, po požití potravy však prudce narůstají v důsledku nervových signálů a zároveň přímého stimulačního účinku potravy na buňky střevní sliznice. Důležitou skutečností je, že účinek GLP‑1 na sekreci inzulinu je tzv. glukózodependentní. To znamená, že se neprojevuje při normálních nebo snížených hladinách glykemie a vymizí i při poklesu postprandiální glykemie na normální hodnotu. Princip fungování inkretinového systému publikoval poprvé již v roce 1964 Elrick, který dokázal, že perorální podání glukózy má za následek mohutnější inzulinovou sekreční odpověď ve srovnání se stejným množstvím glukózy podané intravenózně. To vedlo k objevení obou zmíněných střevních hormonů, které jsou zodpovědné za většinu tzv. inkretinového účinku. K rozvoji léčebného uplatnění inkretinů v léčbě cukrovky vedlo zejména zjištění, že u pacientů s diabetem 2. typu jsou na rozdíl od zdravých lidí koncentrace GLP‑1 snížené, jeho účinek je nicméně zachován. Nevýhodou z hlediska terapeutického užití GLP‑1 je však velmi krátký poločas účinku (pouze 2– 7 min). Po intravenózním podání je totiž poměrně rychle degradován enzymem dipeptidyl‑ peptidázou‑ 4 (DPP‑ 4).
Z uvedeného vyplývá, že bylo nezbytné hledat možnosti, jak rozkladné působení tohoto enzymu obejít. První možností bylo najít molekuly, které budou vůči DPP‑ 4 rezistentní a nebudou tak rychle podléhat rozkladu. Tyto látky se označují jako agonisté či analoga GLP‑1. Druhým řešením je zablokovat degradační aktivitu enzymu DPP‑ 4, který se tím pádem stane neškodným.
Agonisté (analoga) GLP‑1
Jak jsem již zmínil, lze použitím zvířecích inkretinů či změnou molekuly GLP‑1 dosáhnout prodloužení jeho účinku. Mezi představitele této lékové skupiny agonistů (analog) GLP‑1 dostupných i u nás patří exenatid, liraglutid a lixisenatid. Agonisté GLP‑1 působí na pankreatický receptor pro GLP‑1 a v lidském organizmu účinkují stejně jako lidský hormon, na rozdíl od něj jsou však mnohem odolnější vůči působení DPP‑ 4. Mezi nejčastější nežádoucí účinky agonistů GLP‑1 patří nevolnost, zvracení a průjem. Při postupném zvyšování dávky se však toto riziko minimalizuje a jen zřídka vede k nutnosti vysazení medikace. Riziko hypoglykemie při léčbě GLP‑1 agonisty je velmi malé, zvyšuje se pouze v kombinaci s léky ze skupiny derivátů sulfonylurey. Ve srovnání s jinými perorálními antidiabetiky či inzulinem však vede podávání analog GLP‑1 k pozvolnému a konzistentnímu snížení tělesné hmotnosti (dosahujícímu obvykle 3– 5 kg), a to nezávisle na snížení hladin glykemie. Nadějné jsou i experimentálně potvrzené příznivé účinky analog GLP‑1 na regeneraci beta‑buněk, na snížení jejich apoptózy stejně tak jako na endoteliální a vaskulární dysfunkci [13].
Inhibitory DPP‑ 4 (gliptiny)
Druhou skupinou léků využívajících inkretinový efekt k zvýraznění inzulinové sekrece a snížení hladin krevního cukru jsou inhibitory DPP‑ 4 neboli gliptiny. Princip jejich působení spočívá v potlačení aktivity enzymu DPP‑ 4, a tím v prodloužení biologického poločasu a zvýšení koncentrace vlastního aktivního GLP‑1. Z hlediska vlivu na hmotnost mají DPP‑ 4 inhibitory na rozdíl od analog GLP‑1 efekt spíše váhově neutrální. Předností gliptinů je perorální podávání a velice nízká četnost nežádoucích účinků. Mezi inhibitory DPP‑ 4 v současnosti dostupné i v ČR patří sitagliptin, vildagliptin, saxagliptin a linagliptin. Gliptiny mají podobně jako předešlá skupina agonistů GLP‑1 své místo zejména v kombinační léčbě po boku metforminu, případně i v kombinaci s dalšími perorálními antidiabetiky či bazálním inzulinem.
Agonisté receptoru GPR119
Úspěch léčby založený na inkretinovém efektu podnítil další výzkum zaměřený na propojení tenkého střeva a pankreatu. Protein s označením GPR119 je receptorem, který je exprimován jak v pankreatu, tak i v endokrinně aktivních buňkách trávicího traktu. Aktivace GPR119 receptorů zvyšuje intracelulární akumulaci cyklického adenosinmonofosfátu (cAMP), která vede ke zvýšené glukózodependentní sekreci inzulinu z beta‑buněk pankreatu, dále pak i ke zvýšenému uvolňovaní dobře známých inkretinových hormonů GLP‑1, GIP a PYY (polypeptid YY). Kromě zmíněného zvýšení koncentrace cAMP byla po aktivaci GPR119 zaznamenána zvýšená sekrece inzulinu zprostředkovaná uzavřením ATP senzitivních K+ kanálů a následným otevřením napěťově řízených kalciových kanálů. Do dnešních dnů bylo objeveno několik syntetických ligandů, které se váží k GPR119 receptoru a které ho aktivují a označují se jako agonisté GPR119. Preklinické a klinické studie provedené do současné chvíle oprávněně vytyčují tyto molekuly jako další nadějnou lékovou skupinu v léčbě diabetu 2. typu [14].
Agonisté receptoru GPR40
Mezi nejvýznamnější aktivátory inzulinové sekrece patří, jak je známo – kromě glykemie, inkretinů a dalších – i volné mastné kyseliny (VMK – free fatty acids), a to jak prostřednictvím intracelulárních signálních kaskád, tak i přes povrchové receptory GPR40 (G‑ protein – coupled receptor 40), které jsou zakódovány v genu nesoucím označení free fatty acid receptor 1 (FFAR1). V současné době již jsou ve stadiu preklinického a klinického testování malé, experimentálně vyvinuté molekuly imitující působení VMK na GPR40 receptory. Dostupné výsledky z těchto menších studií in vitro a in vivo na myších (resp. potkaních) modelech a ze studií fází I a II mluví o efektu agonistů GPR40 receptorů na zvýšení inzulinové sekrece, snížení lačné i postprandiální glykemie a glykovaného hemoglobinu [15].
Inhibitory SGLT2
Zcela nová, perspektivní třída perorálních antidiabetik, jejichž účinek je založen na inhibici selektivních inhibitorů glukózových transportérů SGLT2 (sodium glucose co‑ transporter), staví do pomyslného světla reflektorů ledviny. Až dosud se totiž považovaly spíše za oběť chronického působení hyperglykemie, nikoli za orgán aktivně se podílející na regulaci glukózové homeostázy. SGLT2 je hlavním transportérem zodpovědným za reabsorpci glukózy z glomerulárního filtrátu zpět do krevního oběhu. Inhibitory SGLT2 – glifloziny (podle hlavních představitelů dapagliflozinu, sergliflozinu, canagliflozinu a dalších) – působí jako glukuretika, která zbavují organizmus nadbytečné glukózy prostřednictvím močových cest (podobně jako to činí diuretika v případě vody a minerálů), a sice zamezením aktivní reabsorpce glukózy v ledvinách, vyvolávají arteficiální glykosurii, a redukují tak hlavní nežádoucí symptom diabetu – hyperglykemii.
Představa arteficiální glykosurie, kterou tyto léky vyvolávají, jako léčebného prostředku jistě vyvolává řadu obav a rozpaků, podle dosavadních dat z klinických studií je však povaha nežádoucích účinků spojených s léčbou inhibitory SGLT2 nezávažná a jejich přínos pro pacienty s diabetem by měl vysoce převažovat rizika. Průvodním jevem podávání gliflozinů je navíc konstantní snížení hmotnosti, které se dosáhlo během poměrné krátké doby podávání (3– 6 měsíců), obvykle kolem 2– 3 kg. Tento hmotnostní úbytek lze dát do souvislosti s negativní energetickou bilancí dosaženou pomocí akcentované glykosurie (50– 85 g glukózy v moči představuje 200– 340 kcal denně). V monoterapii nebo po přidání k metforminu vedlo podávání dapagliflozinu během 3– 6měsíční periody k signifikantnímu snížení krevního tlaku. Systolický tlak poklesl při dávce 10 mg dapagliflozinu denně o 3– 5 mmHg, diastolický tlak o 2 mmHg bez patrných změn srdeční frekvence či výskytu kolapsových stavů. Tento nepatrný, ale zjevný antihypertenzní efekt lze dát do souvislosti se zvýšenou exkrecí natria provázející glykosurii. Zároveň zde může být patrný i efekt redukce hmotnosti již dříve popsaný ve studiích zaměřených na hubnutí [15,16].
Další potenciální antidiabetika
Další rozvíjející se skupinou antidiabetik jsou blokátory glukagonového receptoru. Představitelé této skupiny s označením MK‑ 0893 i LY‑ 2409021 vedli ve srovnání s placebem u zdravých dobrovolníků i pacientů s diabetem 2. typu k inhibici glukagonem podmíněné hyperglykemie i k poklesu glykovaného hemoglobinu bez zjevného ovlivnění reakce organizmu na hypoglykemii [17– 19].
Účinnost a bezpečnost pro léčbu diabetu 2. typu byla dále dokumentována po podávání blokátoru receptoru chemokinu CCR2 (molekula nese označení CCX‑ 140). Tato intervence vedla ve srovnání s placebem ke snížení hodnoty HbA1c bez nežádoucího ovlivnění monocytů. Příznivé výsledky na míru zvýšení sekrece inzulinu beta‑buňkou byly prokázány po aplikaci canakinumabu, resp. LY‑ 2189102, což jsou protilátky neutralizující efekt interleukinu‑ 1beta [20].
Další neprobádanou cestou vedoucí potenciálně k příznivému ovlivnění patofyziologických pochodů spojených s diabetem jsou sirtuiny – nitrobuněčné proteiny regulující řadu metabolických dějů včetně apoptózy a řízení energetické bilance buněk. Aktivace NAD‑ dependentní deacetylázy sirtuin‑1 prostřednictvím působku s označením SRT‑ 2104 vedla v experimentu ke zlepšení citlivosti na inzulin a akcentaci využití glukózy na periferii [21].
Již delší dobu se ví o antidiabetickém potenciálu aspirinu – kyseliny acetylsalicylové podávaného ve vysokých dávkách (4– 7 g/ den), které by vedly u lidí k neúměrnému riziku žaludečních vředů a s tím spojených krvácivých komplikací. Dimer kyseliny salicylové salsalát, ve světě dlouhá léta používaný zejména v léčbě revmatických onemocnění, je ekvipotentním inhibitorem NF‑ κB, ve srovnání s aspirinem však představuje minimální riziko gastrointestinálního krvácení. Recentní randomizovaná, placebem kontrolovaná studie prokázala účinnost i dobrý bezpečnostní profil salsalátu u osob s prediabetem [22].
Randomizovaná studie prokázala účinek diacereinu (látka s protizánětlivými účinky, jejíž mechanizmus účinku je blokáda interleukinu‑ 1, proteinu účinkujícího v zánětlivém procesu včetně rozvoje osteoartrózy a jiných kloubních onemocnění) na zvýšení sekrece inzulinu a další metabolické parametry u osob s diabetem 2. typu [23].
Specifickou oblastí výzkumu je snaha o imunomodulaci autoimunitního procesu provázejícího rozvoj diabetu 1. typu. Publikovaná data prokázala zablokování aktivace T lymfocytů a zpomalení destrukce beta‑buněk pankreatu po podávání abataceptu. Jiným přístupem je vakcinace (Bacillus Calmette‑ Guérin vakcína či plazmidová vakcína BHT‑ 3021 založená na molekule proinzulinu), případně aplikace monoklonálních protilátek proti anti‑CD3 nebo rekombinantní humánních protilátek anti‑GD65 [24,25].
Závěr
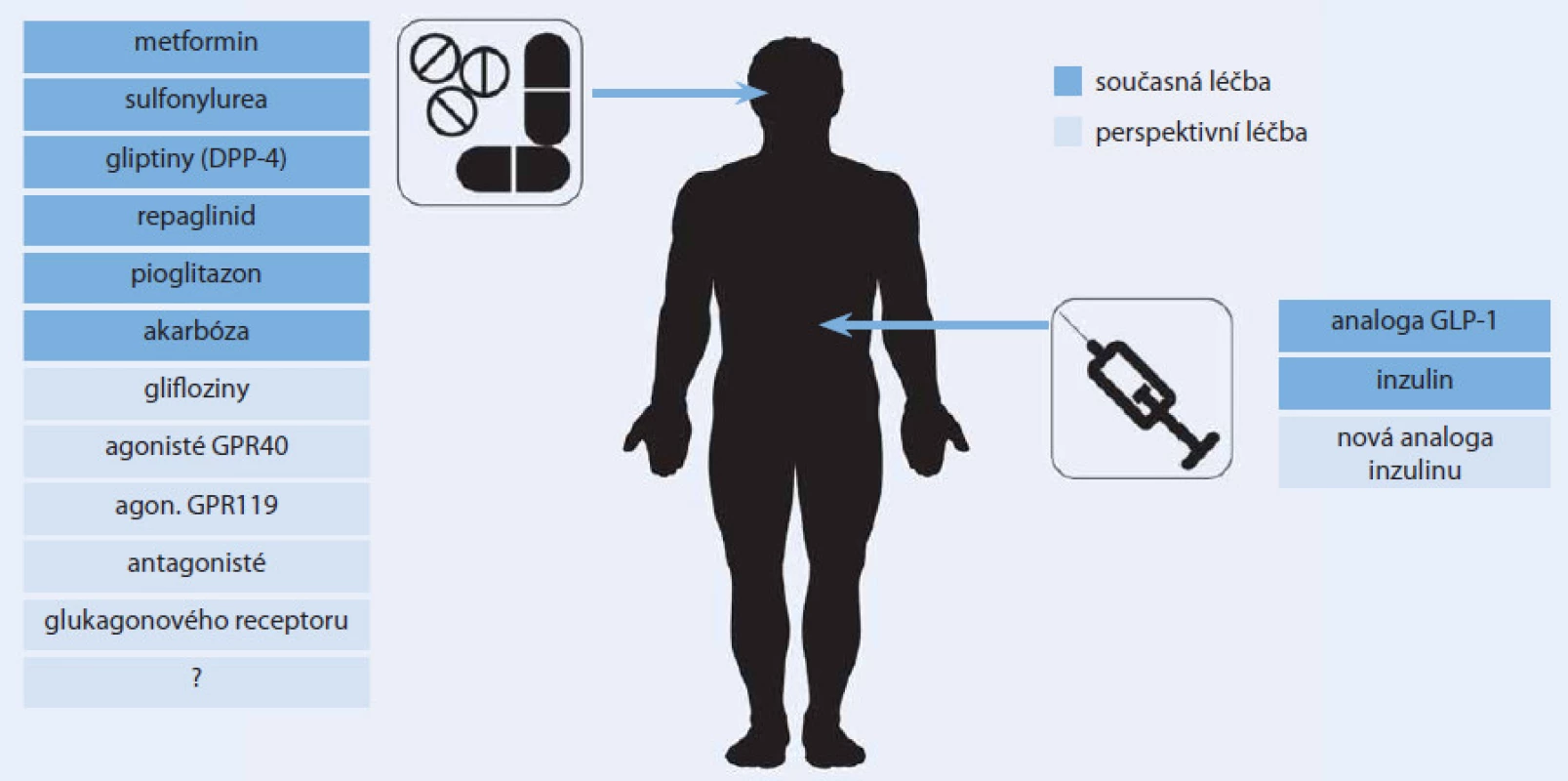
Výčet aktuální i perspektivní farmakoterapie diabetu uvedený v tomto článku je skutečně pestrý (obr. 3). A to zdaleka není úplný. Zmínit by se dala ještě řada dalších perspektivních léků a lékových skupin, jejichž názvům rozumí zatím pouze hrstka zasvěcených, které však možná budou za pár let na pultech lékáren stejně běžné, jako je dnes třeba metformin. Spektrum možností léčby diabetu se v minulých letech významně rozšířilo a nejinak tomu bude i v letech příštích. Jaké místo si jednotlivé lékové skupiny a jejich konkrétní představitelé vybudují v oficiálních či individuálních algoritmech léčby diabetu každého lékaře, bude záležet především na jejich účinnosti a bezpečnosti. O co větší možnost volby budeme mít při výběru antidiabetické léčby, o to více do popředí logicky opět vystoupí ono umění léčit. V tomto případě zvolit pro konkrétního pacienta s konkrétní kombinaci charakteristik v konkrétním časovém období diabetu „to pravé“, v daný moment nejúčinnější a nejbezpečnější antidiabetikum, resp. jejich kombinaci.
Doručeno do redakce 10. 4. 2014
Přijato po recenzi 16. 4. 2014
MU Dr. Tomáš Edelsberger
www.diakrnov.cz
edelsberger@gmail.com
Zdroje
1. Zinman B, Philis‑ Tsimikas A, Cariou B et al. Insulin degludec versus insulin glargine in insulin‑naive patients with type 2 diabetes: a 1‑year, randomized, treat‑ to‑ target trial (BEGIN Once Long). Diabetes Care 2012; 35: 2464– 2471. doi: 10.2337/ dc12– 1205.
2. Gough SC, Harris S, Woo V et al. Insulin degludec: overview of a novel ultra long‑acting basal insulin. Diabetes Obes Metab 2012; 15: 301– 309. doi: 10.1111/ dom.12052.
3. Rosenstock J, Bergenstal RM, Blevins TC et al. Better Glycemic Control and Weight Loss With the Novel Long‑Acting Basal Insulin LY2605541 Compared With Insulin Glargine in Type 1 Diabetes: A randomized, crossover study. Diabetes Care 2012; 36: 522– 528. doi: 10.2337/ dc12– 0067.
4. Bergenstal RM, Rosenstock J, Arakaki RF et al. A randomized, controlled study of once‑ daily LY2605541, a novel long‑acting basal insulin, versus insulin glargine in basal insulin‑treated patients with type 2 diabetes. Diabetes Care 2012; 35: 2140– 2147. doi: 10.2337/ dc12– 0060.
5. Caparrotta TM, Evans M. PEGylated insulin Lispro, (LY2605541)– a new basal insulin analogue. Diabetes Obes Metab 2013. doi: 10.1111/ dom.12196.
6. A Study of LY2605541 in Participants With Type 2 Diabetes Mellitus (IMAGINE 5). [online] Available from: http:/ / clinicaltrials.gov/ show/ NCT01582451
7. Morrow L, Muchmore DB, Hompesch M et al. Comparative pharmacokinetics and insulin action for three rapid‑ acting insulin analogs injected subcutaneously with and without hyaluronidase. Diabetes Care 2013; 36: 273– 275. doi: 10.2337/ dc12– 0808.
8. ORMD 0801 – Oral Insulin Capsule. [online] Available from: http:/ / oramed.com/ index.php?page=14
9. Zisser H, Jovanovic L, Markova K et al. Technosphere insulin effectively controls postprandial glycemia in patients with type 2 diabetes mellitus. Diabetes Technol Ther 2012; 14: 997– 1001. doi: 10.1089/ dia.2012.0101.
10. Kovatchev BP, Renard E, Cobelli C et al. Feasibility of outpatient fully integrated closed‑ loop control: first studies of wearable artificial pancreas. Diabetes Care 2013; 36:1851– 1858. doi: 10.2337/ dc12– 1965.
11. Phillip M, Battelino T, Atlas E et al. Nocturnal glucose control with an artificial pancreas at a diabetes camp. N Engl J Med 2013; 368: 824– 833. doi: 10.1056/ NEJMoa1206881.
12. Forst T, Weber MM, Pfützner A. Cardiovascular benefits of GLP‑1‑based herapies in patients with diabetes mellitus type 2: effects on endothelial and vascular dysfunction beyond glycemic control. Exp Diabetes Res 2012; 2012: 635472. doi: 10.1155/ 2012/ 635472.
13. Edelsberger T. Perspektivy v léčbě diabetu 2. typu – agonisté GPR119. In: Kvapil M. Diabetologie 2014. Praha: Triton 2014.
14. Edelsberger T. Perspektivy v léčbě diabetu 2. typu – agonisté GPR40. In: Kvapil M. Diabetologie 2014. Praha: Triton 2014.
15. Edelsberger T. Glukuretika (inhibitory SGLT2, glifloziny) v léčbě diabetu. Remedia 2011; 1. [online] Dostupné z: http:/ / www.remedia.cz/ Clanky/ Prehledy‑ nazory‑ diskuse/ Glukuretika‑inhibitory‑ SGLT2– glifloziny‑ v‑ lecbe‑ diabetu/ 6- F‑ 11R.magarticle.aspx
16. Edelsberger T. Perspektivy farmakoterapie diabetu 2. typu: Inhibitory SGLT2. DMEV 2009; 12: 9– 14.
17. Edelsberger, T. Perspektivy farmakoterapie diabetu 2. typu: aktivátory glukokinázy. DMEV 2009; 13: 113– 120.
18. The Web site devoted to the study of the glucagon‑like peptides. [online] Available from: http:/ / www.glucagon.com/ glucagonreceptorantag.html
19. Xiong Y, Guo J, Candelore MR et al. Discovery of a novel glucagon receptor antagonist N‑ [(4- {(1S)- 1- [3- (3, 5- dichlorophenyl)- 5- (6– methoxynaphthalen‑ 2- yl)- 1H‑ pyrazol‑ 1- yl]ethyl}phenyl)carbonyl]- b‑ alanine (MK‑ 0893) for the treatment of type II diabetes. J Med Chem 2012; 55: 6137– 6148. doi: 10.1021/ jm300579z.
20. Sullivan TJ, Dairaghi DJ, Krasinski A et al. Characterization of CCX140– B, an orally bioavailable antagonist of the CCR2 chemokine receptor, for the treatment of type 2 diabetes and associated complications. J Pharmacol Exp Ther 2012. doi: 10.1124/ jpet.111.190918.
21. Hoffmann E, Wald J, Lavu S et al. Pharmacokinetics and tolerability of SRT2104, a first‑ in‑class small molecule activator of SIRT1, after single and repeated oral administration in man. Br J Clin Pharmacol 2013; 75: 186– 196. doi: 10.1111/ j.1365– 2125.2012.04340.x.
22. Goldfine AB, Conlin PR, Halperin F et al. A randomised trial of salsalate for insulin resistance and cardiovascular risk factors in persons with abnormal glucose tolerance. Diabetologia 2013; 56: 714– 723. doi: 10.1007/ s00125– 012– 2819– 3.
23. Ramos‑ Zavala MG, González‑ Ortiz M, Martínez‑ Abundis E et al. Effect of diacerein on insulin secretion and metabolic control in drug‑naive patients with type 2 diabetes: a randomized clinical trial. Diabetes Care 2011; 34: 1591– 1594. doi: 10.2337/ dc11– 0357.
24. Orban T, Bundy B, Becker DJ et al. Type 1 Diabetes TrialNet Abatacept Study Group. Co‑ stimulation modulation with abatacept in patients with recent‑ onset type 1 diabetes: a randomised, double‑blind, placebo‑ controlled trial. Lancet 2011; 378: 412– 419. doi: 10.1016/ S0140– 6736(11)60886– 6.
25. Lernmark A, Larsson HE. Immune therapy in type 1 diabetes mellitus. Nat Rev Endocrinol 2013; 9: 92– 103. doi: 10.1038/ nrendo.2012.237.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2014 Číslo 2
Nejčtenější v tomto čísle
- Centrálně působící antihypertenziva – rilmenidin
- Mechanická podpora oběhu v léčbě kardiogenního šoku – přehled
- Mechanické podpory a transplantace srdce v léčbě chronického srdečního selhání
- Nefarmakologická léčba srdečního selhání z pohledu nových evropských doporučení pro srdeční resynchronizační léčbu