Hypertyreóza a srdce
Autoři:
J. Jiskra
Působiště autorů:
III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise:
Kardiol Rev Int Med 2018, 20(3): 167-172
Souhrn
Hormony štítné žlázy významně ovlivňují činnost srdce a cév. Nejen rozvinutá, ale i subklinická hypertyreóza (vč. předávkování levotyroxinem) jsou spojeny s významnými kardiovaskulárními riziky, což se týká zejména starších pacientů. K léčbě subklinické hypertyreózy u pacientů se srdečním onemocnění proto přistupujeme častěji než k léčbě subklinické hypotyreózy za předpokladu, že se jedná o trvalý stav a nejde o nespecifickou supresi tyreoidálního stimulačního hormonu (TSH) v rámci syndromu nízkého trijodtyroninu (T3). Podmínkou účinné a bezpečné terapie amiodaronem indukované hypertyreózy je rozlišení I. a II. typu. První typ se léčí methimazolem, event. chloristanem, a bývá dlouhá odpověď na terapii, II. typ se léčí glukokortikoidy, reaguje na terapii rychleji a častěji přechází do trvalé remise nebo do hypotyreózy. Amiodaron se doporučuje ponechat u život ohrožujících arytmií nebo u pacientů v kritických stavech. V ostatních případech se postupuje individuálně. Úzká spolupráce kardiologa s endokrinologem je v těchto případech nezbytná.
Klíčová slova
hypertyreóza – fibrilace síní – kardiovaskulární riziko – srdeční selhání – amiodaronem indukovaná tyreotoxikóza – tyreoidální stimulační hormon
Hormony štítné žlázy významně ovlivňují činnost srdce a cév. Neléčená rozvinutá hypertyreóza je nepochybně spojena s významnými kardiovaskulárními (KV) riziky. Z metaanalýz a velkých klinických studií v posledních 10 letech vyplývá, že rovněž subklinická hypertyreóza (vč. předávkování tyreoidálními hormony) přináší nemocným závažná KV rizika, která jsou pravděpodobně významnější než u subklinické hypotyreózy a týkají se zejména starších pacientů.
Mechanizmus působení tyreoidálních hormonů na KV systém
Tyreoidální hormony ovlivňují srdeční výkon působením na srdeční sval a na cévní systém nejen u plně rozvinutých forem, ale i u forem subklinických. Biologicky účinným hormonem je trijodtyronin (T3), který je nezbytný k ochraně morfologie a výkonnosti srdce, a srdce je citlivé jak na jeho nedostatek, tak nadbytek. Za fyziologických okolností většina T3 vzniká dejodací z tyroxinu (T4) ve štítné žláze a v periferních tkáních působením enzymů dejodáz a jen malá část T3 (asi 20 %) vzniká ve štítné žláze syntézou. Má vliv na metabolizmus řady důležitých strukturálních i funkčních srdečních proteinů, a to mechanizmem geonomickým (jaderné účinky prostřednictvím exprese nových proteinů) a negenomickým (mimojaderné účinky). Nástup negenomických účinků je rychlý (řádově několik sekund až minut) a některé z nich lze rychle ovlivnit blokádou adrenergních receptorů, zatímco genomické účinky nastupují pomalu (v řádu dnů až týdnů) a jejich efekt v periferních tkáních přetrvává ještě několik dnů až týdnů poté, co se při léčbě vrátí cirkulující tyreoidální hormony do referenčního rozmezí. Při hypertyreóze je celková produkce T3 zvýšená, dochází ke zrychlení srdeční frekvence, síly srdečního stahu a minutového srdečního výdeje. Tyreoidální hormony mají také významný proangiogenetický efekt, který začíná vazbou T3 na receptor pro integrin αvβ3 [1] a účastní se ho známé růstové faktory VEGF (vascular endothelial growth factor) a FGF (fibroblast growth factor).
Kardiovaskulární důsledky hypertyreózy
Kardiovaskulární důsledky hypertyreózy jsou shrnuty v tab. 1. Hypertyreóza vyvolává tachykardii a hyperkinetickou cirkulaci, a přestože zvyšuje sílu srdečního stahu, může vyústit do srdečního selhání. Nejčastější a známou KV komplikací hypertyreózy je fibrilace nebo flutter síní. Před více než 20 lety Sawin et al publikovali 3× vyšší riziko vzniku fibrilace síní u osob > 60 let se supresí tyreoidálního stimulačního hormonu (TSH) [2]. Ve většině případů – zejména u mladších jedinců – jde o postižení reverzibilní a po vyřešení tyreotoxikózy dojde ke spontánní verzi na sinusový rytmus. Dlouhodobá neléčená hypertyreóza vede k hypertyreózní kardiomyopatii („cor thyreotoxicum“), která je spojena s funkčním i strukturálním srdečním postižením. Na buněčné úrovni jsou nejvíce postiženy mitochondrie, což redukcí aktivity cytochrom C oxidázy vede k oxidačnímu stresu, nedostatečné tvorbě energie a následně i dysfunkci myocytů [3]. I pacienti se subklinickou hypertyreózou mají oproti kontrolám častěji hypertrofii levé srdeční komory [4]. V metaanalýze 12 prospektivních studií z let 1950– 2008 zahrnující 140 449 osob zvyšovala subklinická hypertyreóza oproti kontrolám KV morbiditu o 21 %, KV mortalitu o 19 % a celkovou mortalitu o 12 % a subklinická hypotyreóza o 20, 18 a 12 % [5]. Cappola et al v prospektivní studii z let 1989– 1990 zjistili, že subklinická hypertyreóza byla spojena s rizikem fibrilace síní [6]. KV rizika subklinické hypertyreózy jsou vyšší než u subklinické hypotyreózy [7]. V posledních 10 letech dvě metaanalýzy neprokázaly [8,9] a čtyři prokázaly [7,10– 12] u subklinické hypertyreózy zvýšené riziko KV a celkové mortality, především u starších osob a pacientů s komorbiditami. I v nedávné analýze rozsáhlé kohorty 563 700 obyvatel Kodaně, kteří podstoupili preventivní tyreoidální testy, byla u subklinické a manifestní hypertyreózy zvýšena celková mortalita a zvýšený kombinovaný end-point velkých KV příhod [13]. Podobně jako u subklinické hypotyreózy je interpretace výsledků studií částečně limitována mimo jiné geografickými vlivy a odlišnými diagnostickými kritérii pro subklinickou hypertyreózu vlivem současně užívaných léků a komorbidit na tyreoidální testy. Je však zřejmé, že KV rizika spojená s neodůvodněným předávkováním tyreoidálními hormony převyšují KV rizika neléčené subklinické hypotyreózy. Podmínkou terapie levotyroxinem je proto u polymorbidních pacientů ve vyšším věku dobrá compliance a těsná dispenzarizace.

Diagnostika hypertyreózy
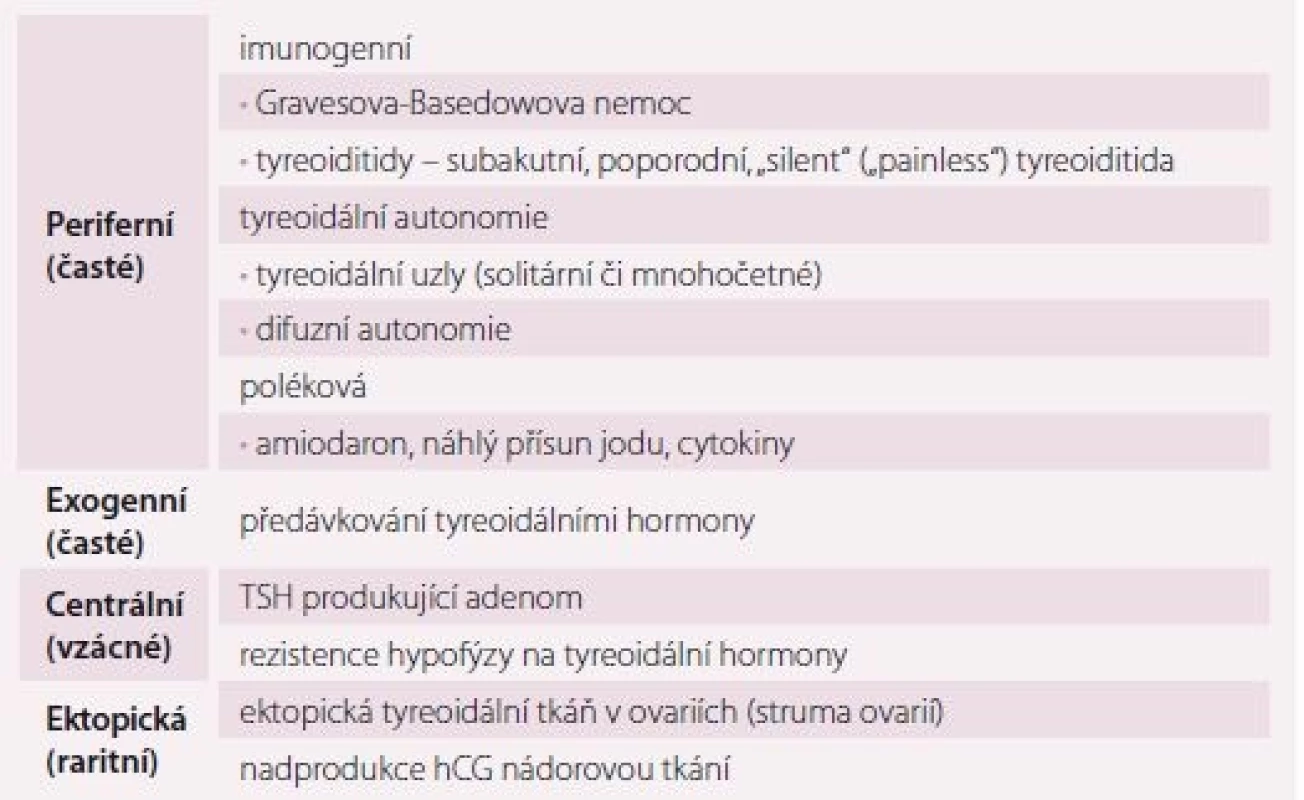
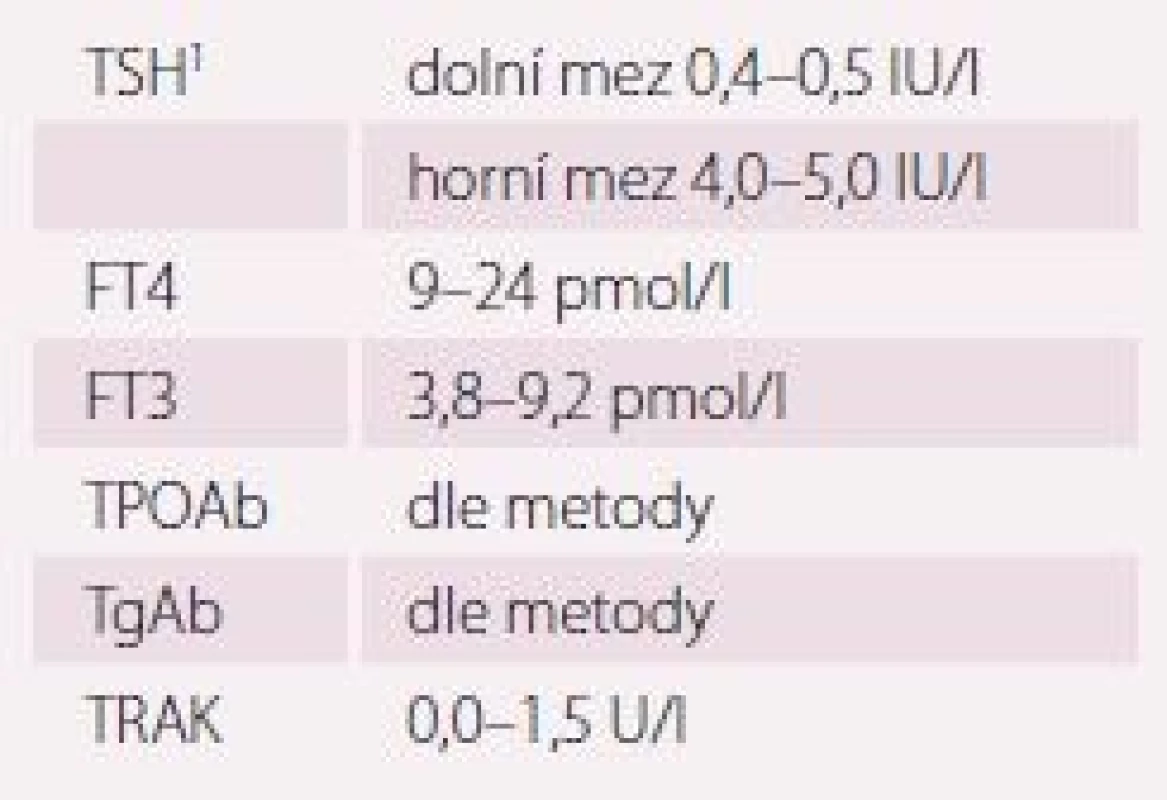
Hypertyreóza znamená nadbytek hormonů štítné žlázy. Centrální hypertyreóza je mimořádně vzácná a diagnostikuje se na podkladě zvýšení volného T4 (FT4) a volného T3 (FT3) v séru při normálním nebo vyšším TSH. Periferní hypertyreóza se diagnostikuje na základě poklesu TSH pod dolní hranici referenčních hodnot příslušné laboratorní metody (obvykle 0,4– 0,5 IU/ L). Je-li provázen vzestupem FT4 a/ nebo FT3, jde o rozvinutou (manifestní) hypertyreózu, jsou-li tyreoidální hormony v normě, jde o subklinickou hypertyreózu. Nejčastější příčiny hypertyreózy jsou v tab. 2, orientační referenční hodnoty pro vyšetřované laboratorní parametry v tab. 3. Důležité je, že suprese TSH může mít i netyreoidální příčinu (tab. 4) a může být jen tranzientní. Tudíž podmínkou diagnózy „subklinická hypertyreóza“ je trvalá (> 3– 6 měsíců) suprese TSH tyreoidální etiologie.
1 horní hranice TSH stoupá s věkem: od 40 let o cca 0,3 IU/L každých 10 let
a normy pro TSH jsou také odlišné (nižší) v graviditě.
TSH – tyreoidální stimulační hormon,
FT3 – volný trijodtyronin, FT4 – volný tyroxin,
TPOAb – protilátky proti tyreoidální
peroxidáze, TRAK – protilátky proti
TSH receptoru , TgAb – protilátky proti
tyreoglobulinu
Léčba hypertyreózy
Léčba hypertyreózy se částečně liší podle příčiny (tab. 2) a patří výlučně do rukou endokrinologa. Má dvě fáze – tzv. iniciální zklidnění a definitivní řešení. Cílem první fáze je co nejrychlejší dosažení eutyreózy podáváním tyreostatik. Nástup jejich účinku je až za několik týdnů, proto je velmi důležité tlumit v úvodu oběhové příznaky hypertyreózy symptomaticky – zpravidla betablokátory. Dnes se vzhledem k menšímu množství nežádoucích účinků upřednostňují kardioselektivní betablokátory, bez vnitřní aktivity, např. metoprolol. Z tyreostatik se upřednostňuje methimazol (thiamazol) před propylthiouracilem z důvodu menšího rizika závažné hepatopatie. Před zahájením tyreostatické léčby by se měl vyšetřit krevní obraz, diferenciální rozpočet leukocytů, bilirubin a jaterní testy. Pravidelné rutinní monitorování krevního obrazu a jaterních testů se v dalším průběhu léčby tyreostatiky nedoporučuje, důležitější (a efektivnější) je dobře poučit pacienta, aby v případě horečnatého onemocnění, při zežloutnutí a jiných příznacích hepatopatie (tmavá moč, acholická stolice, bolesti břicha apod.) lék vysadil a vyhledal lékařskou pomoc s vyšetřením krevního obrazu a jaterních testů. Nemocní s Gravesovou-Basedowovou (GB) chorobou mají asi ve 40– 60 % naději na dlouhodobou remisi po ukončení tyreostatické léčby. Pokud nedojde k remisi GB choroby s možností vysazení tyreostatik do 2– 4 let nebo má onemocnění relabující průběh nebo se jedná o hyperfunkční uzly, je namístě definitivní řešení operační (totální tyreoidektomie), nebo léčba radiojodem 131I. Částečně odlišná je léčba amiodaronem indukované hypertyreózy, která je diskutována v samostatném odstavci.
Léčba subklinické hypertyreózy u pacientů s KV onemocněním
Indikace k léčbě subklinické hypertyreózy nejsou striktně dány. Ukazuje se, že nejméně 25– 50 % odchylek TSH od normy se normalizuje během 3– 6 měsíců [14,15]. U pacientů s KV chorobami se léčba subklinické hypertyreózy zahajuje častěji než u běžné populace, přesto je před zahájením léčby vhodné (pokud se nejedná o stav, kdy subklinická hypertyreóza významně zhoršuje KV kompenzaci nebo o amiodaronem indukovanou tyreotoxikózu – AIT) prokázat kontrolním vyšetřením v odstupu několika týdnů až 6 měsíců (v závislosti na tom, jde-li o rizikového pacienta), že jde o trvalý stav, stanovit příčinu a vyloučit supresi TSH netyreoidální etiologie (tab. 4). Doporučený postup u suprese (snížení) TSH s normálními FT4 a FT3 je na obr. 1.
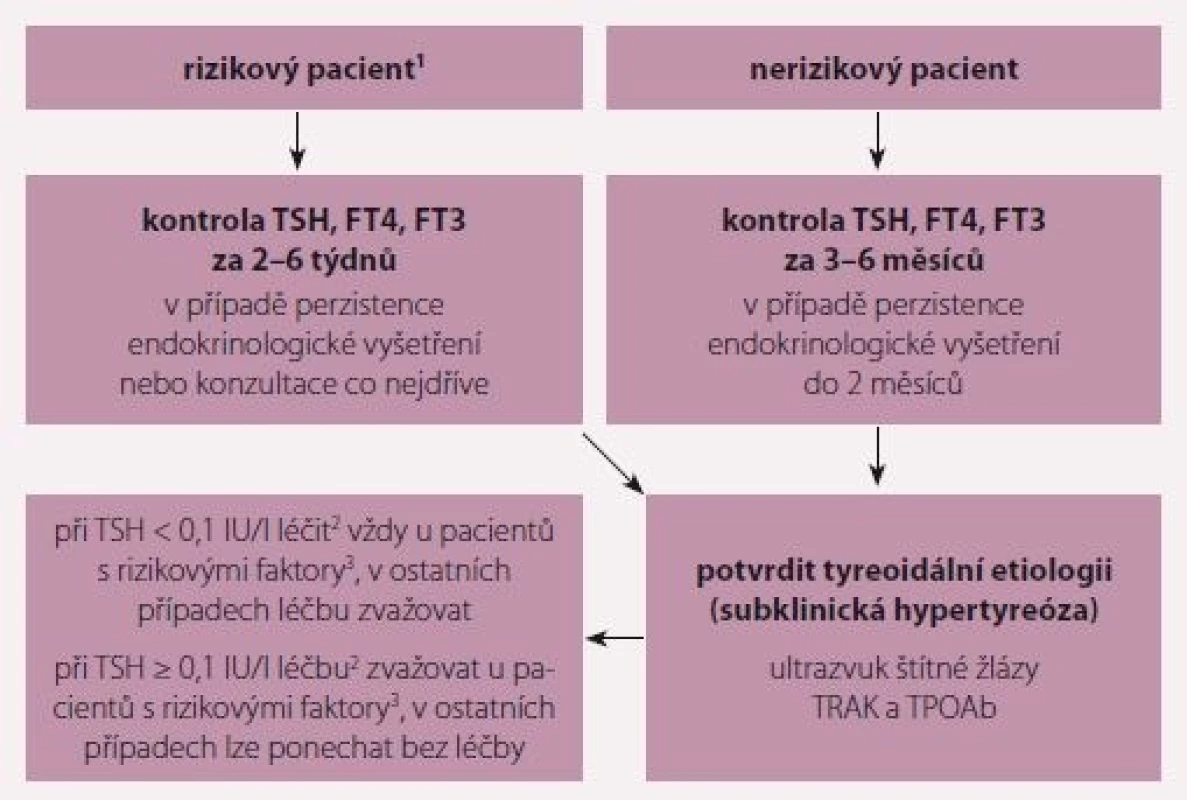
2 operace, léčba radiojodem nebo výjimečně dlouhodobě malé dávky methimazolu
do 10 mg denně
3 pacienti ≥ 65 let nebo s příznaky hypertyreózy nebo s KV chorobami a jejich rizikovými
faktory nebo s osteoporózou nebo postmenopauzální ženy neléčené
estrogeny/bisfosfonáty
TSH – tyreoidální stimulační hormon, FT4 – volný tyroxin, FT3 – volný trijodtyronin,
TRAK – protilátky proti TSH receptoru, TPOAb – protilátky proti tyreoidální peroxidáze,
ICHS – ischemická choroba srdeční, KV – kardiovaskulární
Amiodaronem indukovaná tyreotoxikóza
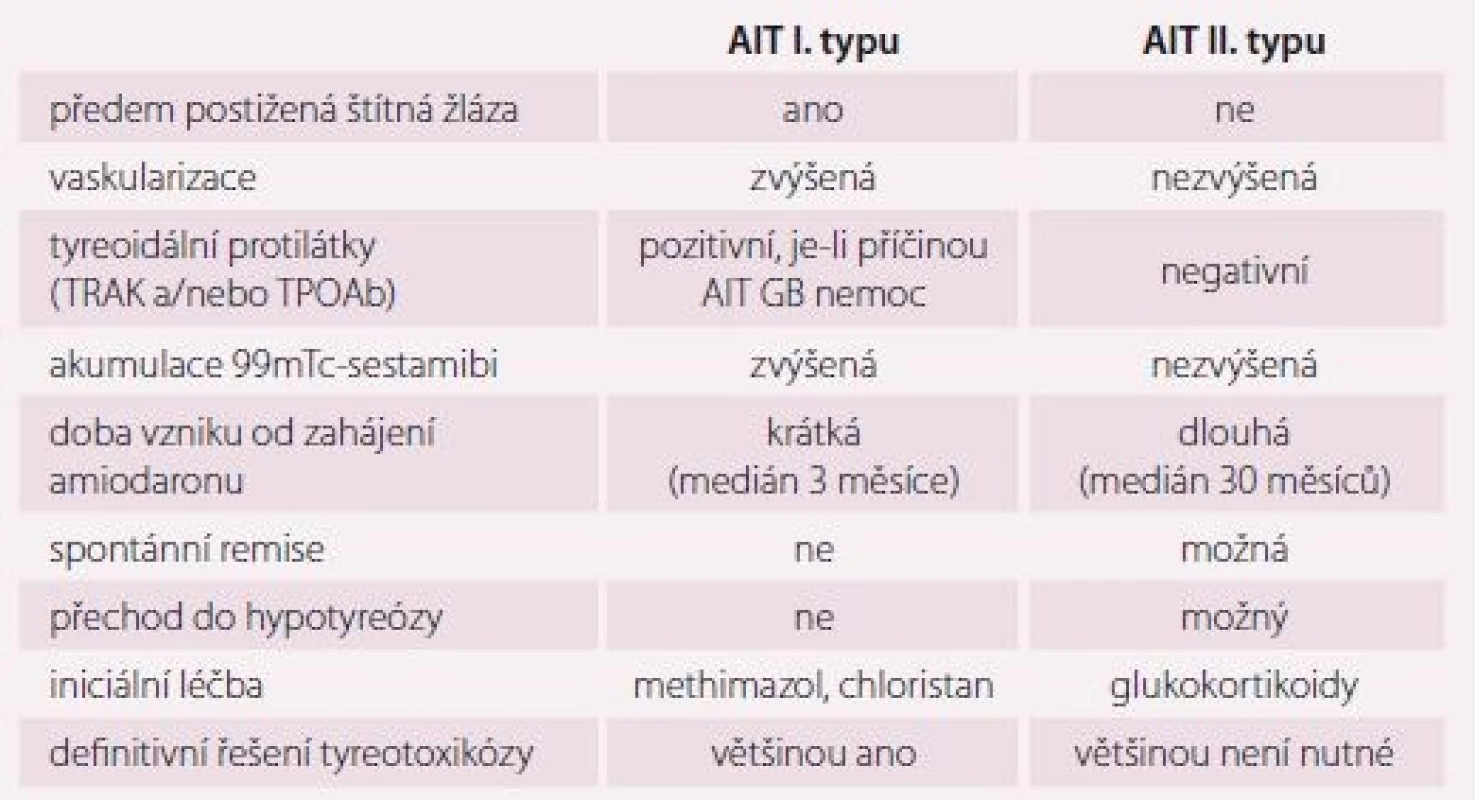
V jodsuficientních oblastech se udává prevalence AIT (AIT) 3– 5 % [16] a převažuje AIT II. typu. V joddeficitních oblastech je výskyt AIT vyšší (10– 12 %) a převažuje typ I [17]. Amiodaron má dlouhý biologický poločas (přes 100 dní) a vysoký obsah jodu. Eliminace látky z organizmu trvá řadu měsíců, někdy i let. Odhaduje se, že 1 tableta amiodaronu à 200 mg je po metabolizaci v játrech zdrojem 6 mg anorganického jodu, což je asi 20– 40násobek průměrného denního příjmu. Příčinou amiodaronové tyreoidální dysfunkce jsou nadměrný přísun jodu a vlastní toxický efekt látky. První mechanizmus vede v jodsuficientních oblastech častěji k hypotyreóze, může však u osob s preexistující tyreopatií (obvykle s polynodózní strumou či latentní GB chorobou) vyvolat i těžkou AIT I. typu. Druhý mechanizmus je destrukční tyreoiditida vlivem přímého toxického vlivu na tyreocyt s rozvojem AIT II. typu, která často přechází do hypofunkce. Hlavní charakteristiky obou forem jsou v tab. 5.
Změny tyreoidálních testů po amiodaronu, které nevyžadují léčbu
Během prvních 4– 8 týdnů terapie amiodaronem stoupá FT4, celkový tyroxin (TT4) a metabolicky neaktivní reverzní T3 (rT3), klesá FT3 a mírně stoupá TSH. Důvodem je snížená aktivita dejodázy II. typu, zvýšená aktivita dejodázy III. typu a snížená citlivost hypofýzy na zpětnou vazbu zprostředkovanou tyreoidálními hormony. Kromě toho metabolit amiodaronu desethylamiodaron inhibuje vazbu T3 na jaderné receptory [18], takže pacienti zůstávají eutyroidní, i když mají vysoký FT4 (TT4). Vysazení amiodaronu může vést k manifestaci (nebo zhoršení) tyreotoxikózy. Poté se během následujících 3– 6 měsíců vyváří nová rovnováha, kdy se normalizuje TSH, TT4 a FT4 zůstávají mírně zvýšené nebo na horní hranici normy a FT3 je na dolní hranici normy [19]. Tyto změny neznamenají tyreoidální dysfunkci a nevyžadují specifickou terapii, pouze sledování (1 × za 3– 6 měsíců).
Diferenciální diagnostika AIT I. a II. typu
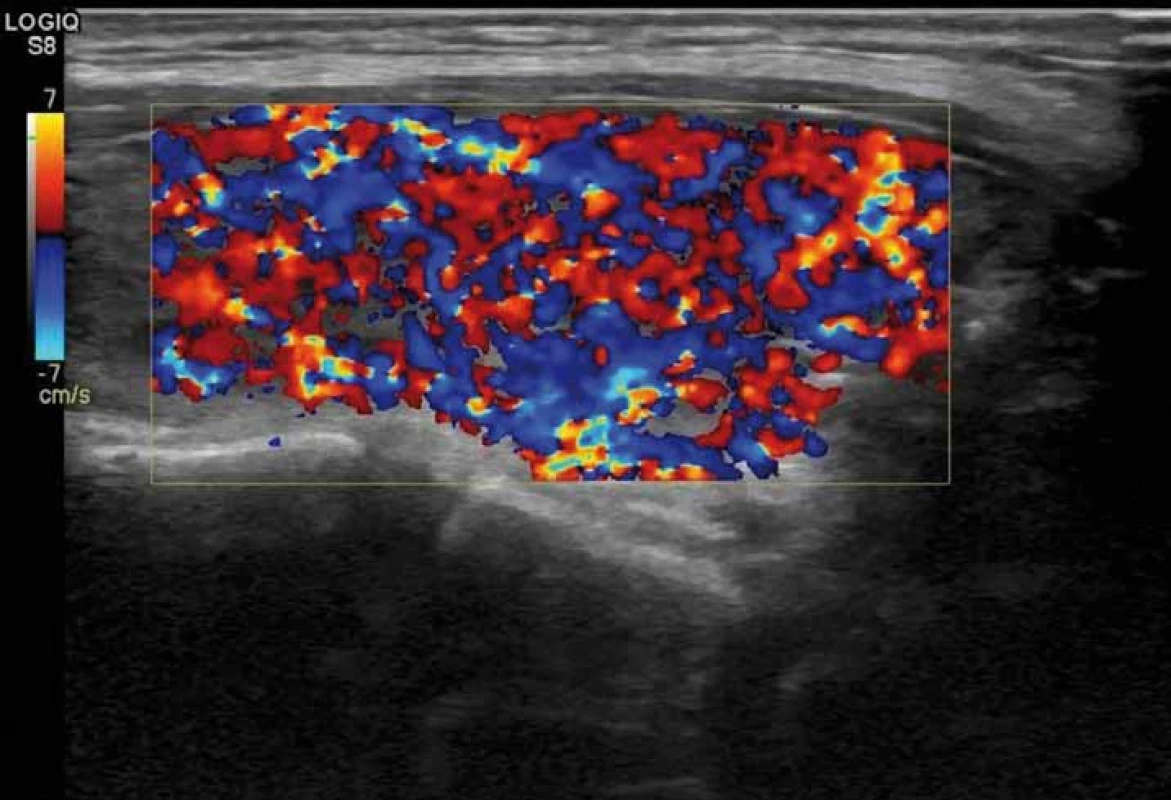
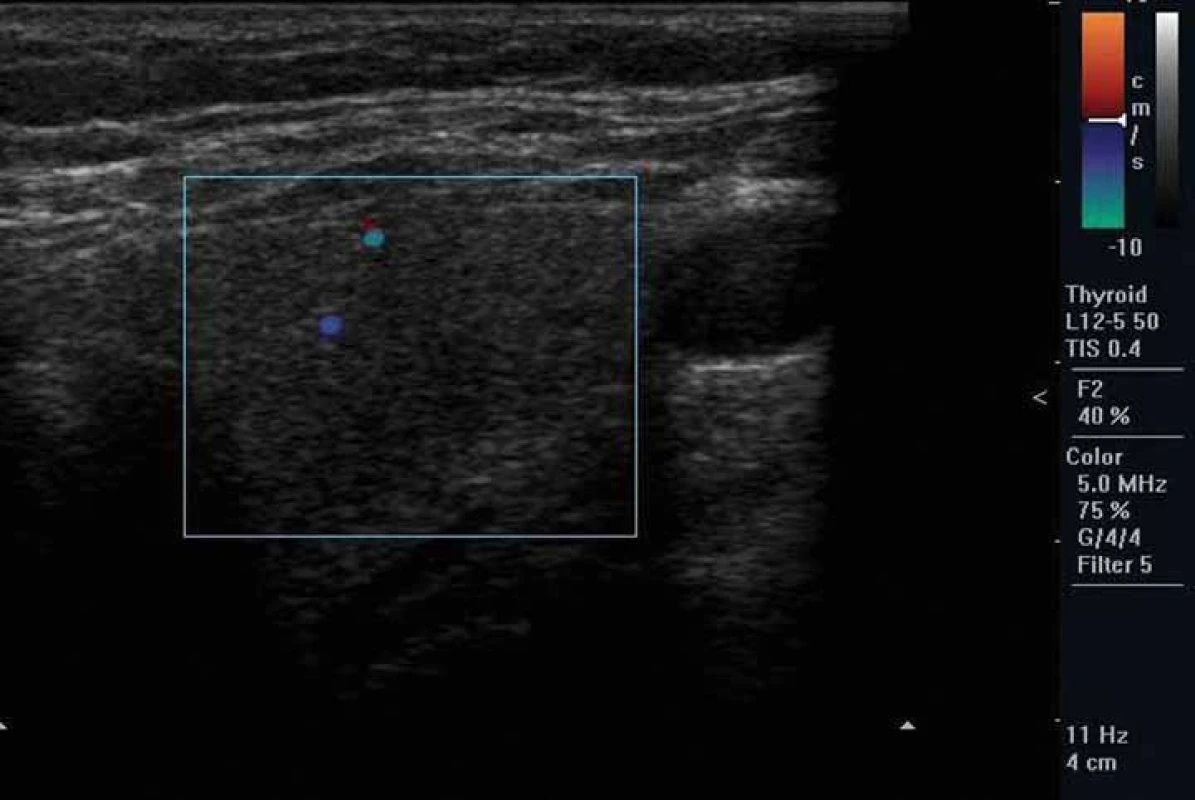
Rozlišení AIT I. a II. typu je důležité pro terapii. U AIT I. typu je zvýšená syntéza tyreoidálních hormonů. Vzniká typicky u osob s latentní GB chorobou nebo polynodózní strumou a patogenetickým mechanizmem je nadměrný přísun jódu. Typická je zvýšená perfuze při dopplerovské sonografii (obr. 2) [20], relativně častá struma, u autoimunitních forem pozitivní protilátky proti TSH receptoru (TRAK), tyreoidální peroxidáze (TPOAb), event. tyreoglobulinu (TgAb). Může být vyšší akumulace při scintigrafii 99mTc-technecium sestamibi nebo 99mTc-pertechnetátem [21], nicméně diagnostická hodnota scintigrafických metod je v jodsuficientních oblastech v této indikaci limitovaná. AIT II. typu vzniká toxickým působením amiodaronu na tyreocyty s následným rozpadem folikulů a uvolněním thyreoidálních hormonů do cirkulace. Typicky vzniká v dosud normální štítné žláze, což ale není podmínkou. Ultrazvukový obraz štítné žlázy může být normální nebo může být hypoechogenní a/ nebo nehomogenní nezvětšená tyreoidea. Typická je chudá perfuze při dopplerovské sonografii (obr. 3) [20] a negativní protilátky. Může být snížená akumulace při scintigrafii 99mTc-technecium sestamibi [21] nebo 99mTc-pertechnetátem.
Terapie AIT
Pokud pacient užívá amiodaron pro život ohrožující arytmie nebo jde o kriticky nemocného, pak se doporučuje ho nevysazovat. Užívá-li ho z důvodu jiných arytmií nebo není efektivní, pak se – zejména u AIT I. typu – doporučuje po konzultaci s kardiologem jeho ukončení a nahrazení jiným antiarytmikem nejlépe v kombinaci s betablokátorem. Podle některých autorů je vhodné ukončit amiodaron až poté, co je dosaženo alespoň částečné kontroly tyreotoxikózy tyreostatiky a/ nebo glukokortikoidy (což obvykle trvá několik týdnů až měsíců), protože by mohlo dojít ke zhoršení z důvodu vzestupu T3, absence inhibičního vlivu amiodaronu na T3 receptor a absence inhibičního vlivu jodu na syntézu tyreoidálních hormonů [22]. U AIT II. typu lze v amiodaronu pokračovat, podle některých studií je ale pak prodloužena doba do dosažení remise tyreotoxikózy a vyšší riziko rekurence [23].
V léčbě AIT I. typu se používá methimazol ve vyšší dávce (40– 60 mg denně) [24]. Někdy je u těžké AIT I. typu s hrozící tyreotoxickou krizí účinnější i intravenózní aplikace methimazolu (preparát Favistan inj. je v ČR k dispozici na mimořádný dovoz) v dávce 40– 120 mg denně. Z důvodu rezistence na tyreostatika při velké jodové zátěži lze na začátku zvážit podávání chloristanu (draselného či sodného) v dávce nepřevyšující 1 g denně po dobu 4– 6 týdnů [25]. Chloristan draselný lze připravit magistraliter. Výroba přípravku s chloristanem draselným (Chlorigen) byla ukončena a přípravek Irenat (s chloristanem sodným) není v ČR registrován. Rizikové pacienty, kde se pokračuje v amiodaronu a současně se podává methimazol, event. chloristan, je nutné připravit k časné totální tyreoidektomii po předchozí lugolizaci (podává se kalium jodid nebo Lugolův roztok i.v. nebo p.o.). Operace je v dalším průběhu nutná až u tří čtvrtin pacientů s AIT I. typu, protože choroba často relabuje po snížení či vysazení tyreostatik.
AIT II. typu dobře a rychle reaguje na glukokortikoidy. Podává se prednison 40– 60 mg denně po dobu 1– 3 měsíců a pak se postupně vysazuje [26]. Alespoň určité zlepšení je obvykle patrné již po 1– 2 týdnech terapie (pokles FT3, menší pokles FT4), což je také potvrzení, že diagnóza II. typu je správná. Většina pacientů s AIT II. typu přejde do remise, často s tranzientní a méně často i trvalou hypotyreózou. Pokud byl amiodaron přechodně vysazen a není jiná možnost, lze jej v indikaci život ohrožujících arytmií znovu použít.
V některých případech nelze jednoznačně určit, zda jde o AIT I. nebo II. typu. To nastává zřejmě nejčastěji, když onemocnění trvá již delší dobu. V těchto případech se doporučuje kombinace 40 mg prednisonu a 40 mg methimazolu denně. Rychlá odpověď na léčbu (během 1– 2 týdnů) svědčí pro AIT II. typu a methimazol lze postupně vysadit. Naopak žádná (minimální) odpověď svědčí pro AIT I. typu a doporučuje se pokračovat v methimazolu, postupně vysadit prednison, event. přidat chloristan draselný a zvažovat operaci (viz výše) po předchozí lugolizaci.
U pacientů, kteří užívají současně amiodaron a warfarin, může amiodaronem indukovaná hypertyreóza zesílit a amiodaronem indukovaná hypotyreóza zeslabit antikoagulační účinek [27]. Navíc se může po přerušení amiodaronu změnit farmakokinetika warfarinu. Proto je u těchto pacientů na místě těsnější monitorace krevní srážlivosti (INR).
Prevence amiodaronové tyreotoxikózy
Před zahájením léčby amiodaronem by se mělo pátrat po tyreopatiích v rodinné a osobní anamnéze, vyšetřit štítnou žlázu palpačně a vyšetřit TSH v séru. V predikci AIT I. typu (nikoli II. typu) a hypotyreózy má význam i vyšetření tyreoidálních protilátek a sonografie (zejména v joddeficitních oblastech). Klinické vyšetření a stanovení TSH by se dále mělo provádět 1× za 3– 6 měsíců během léčby amiodaronem a nejméně rok po jejím ukončení. Za 3 a 6 měsíců po zahájení terapie amiodaronem je vhodné vyšetřit i FT4, protože TSH může být mírně nespecificky zvýšený a diagnóza hypotyreózy je možná jen z poklesu FT4. Absolutní kontraindikací amiodaronu je nevyřešená GB choroba a polynodózní struma s hyperfunkcí. GB nemoc v remisi a eufunkční tyreoidální uzly jsou kontraindikací relativní, zejména v joddeficitních oblastech. U hypotyreózy a/ nebo chronické lymfocytární tyreoiditidy lze amiodaron podávat současně s levotyroxinem. Naděje vkládané do nejodovaného derivátu amiodaronu dronedaronu [28] byly zhaceny jeho hepatotoxicitou, nedostatečným antiarytmickým efektem a negativním vlivem na funkci levé srdeční komory.
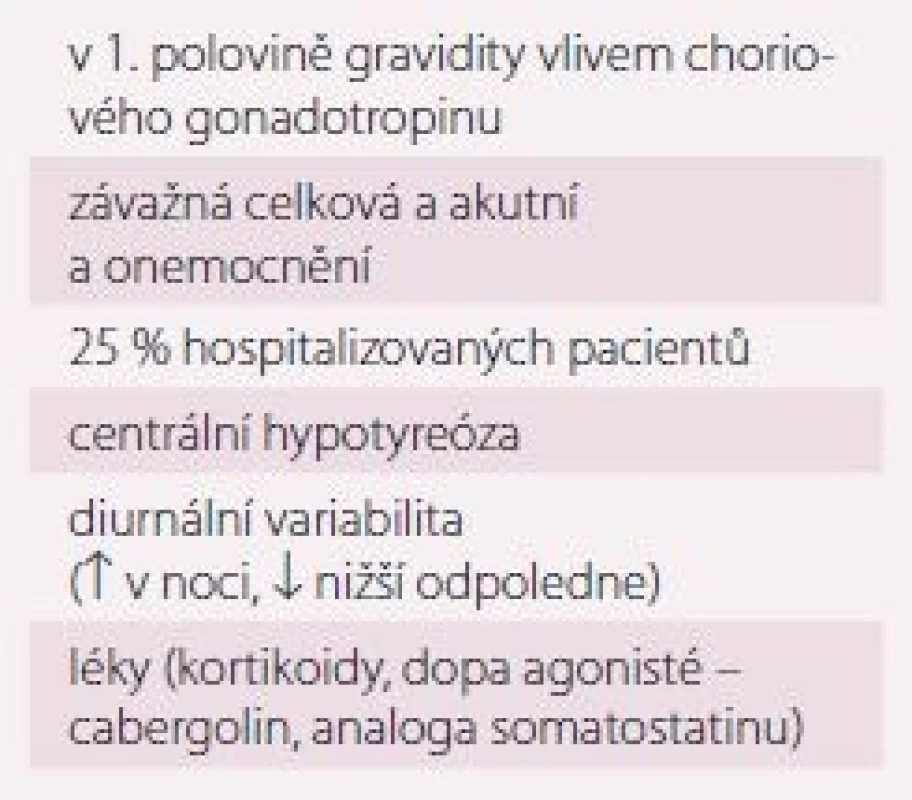
Syndrom nízkého T3
Dejodázy jsou základní enzymy, které regulují tvorbu metabolicky aktivního T3 nebo metabolicky neaktivního reverzního T3 (rT3) z prohormonu tyroxinu (T4) a určují jejich množství na lokální úrovni periferních tkání včetně srdečního svalu. Tři hlavní dejodázy (D1, D2 a D3) jsou exprimovány odlišně v různých tkáních a za fyziologických okolností je jejich činnost v rovnováze. Převažující tvorba rT3 nad produkcí aktivního T3 je ochranným mechanizmem a stav je nazýván syndromem nízkého T3 („non-thyroidal illness, „sick euthyroid syndrome“). Syndrom nízkého T3 je významným průvodním procesem všech akutních a závažných chronických chorob vč. srdečních onemocnění (akutního infarktu myokardu, operací srdce, srdečního selhání a kardiogenního šoku) [29] a hluboký pokles T3 je nepříznivým prognostickým markerem pro přežití [30]. Současně dochází v těchto situacích k nespecifickému poklesu celkového T4 a někdy i volného T4 v krvi. Ve fázi rekonvalescence může naopak dojít k mírnému vzestupu TSH a T4 a T3 se vrací do normy (obr. 4). Znalost těchto změn je důležitá, protože jsou adaptační reakcí a nevyžadují žádnou specifickou terapii, pouze kontrolu s časovým odstupem.
Závěr
Hormony štítné žlázy významně ovlivňují činnost KV systému. Nejen rozvinutá, ale i subklinická hypertyreóza (vč. předávkování levotyroxinem) jsou spojeny s významnými KV riziky, což se týká zejména starších pacientů. K léčbě subklinické hypertyreózy u pacientů se srdečním onemocnění proto přistupujeme častěji než k léčbě subklinické hypotyreózy, za předpokladu, že se jedná o trvalý stav a nejde o nespecifickou supresi TSH v rámci syndromu nízkého T3. Podmínkou účinné a bezpečné terapie amiodaronem indukované hypertyreózy je rozlišení I. a II. typu. První typ se léčí methimazolem, event. chloristanem, a bývá dlouhá odpověď na terapii, II. typ se léčí glukokortikoidy, reaguje na terapii rychleji a častěji přechází do trvalé remise nebo do hypotyreózy. Amiodaron se doporučuje ponechat u život ohrožujících arytmií nebo u pacientů v kritických stavech. V ostatních případech se postupuje individuálně. Úzká spolupráce kardiologa s endokrinologem je v těchto případech nezbytná.
Doručeno do redakce: 25. 6. 2018
Přijato po recenzi: 9. 7. 2018
doc. MU Dr. Jan Jiskra, Ph.D.
Zdroje
1. Davis PJ, Goglia F, Leonard JL. Nongenomic actions of thyroid hormone. Nat Rev Endocrinol 2016; 12(2): 111– 121. doi: 10.1038/ nrendo.2015.205.
2. Sawin CT, Geller A, Wolf P et al. Low serum thyrotropin concentrations as a risk factor for atrial fibrilation in older persons. N Engl J Med 1994; 331(19): 1249– 1952. doi: 10.1056/ NEJM199411103311901.
3. Maity S, Kar D. Hyperthyroidism causes cardiac dysfunction by mitochondrial impairment end energy depletion. J Endocrinol 2013; 217(2): 215– 228. doi: 10.1530/ JOE-12-0304.
4. Tamer I, Sargin M, Sargin H et al. The evaluation of left ventricular hypertrophy in hypertensive patients with subclinical hyperthyroidism. Endocr J 2005; 52(4): 421– 425.
5. Rodondi N, Bauer DC, Cappola AR et al. Subclinical thyroid disease linked with modest risk of heart disease and mortality. J Am Coll Cardiol 2008; 52(4): 1152– 1159. doi: 10.1016/ j.jacc.2008.07.009.
6. Cappola AR, Fried L, Arnold A et al. Thyroid status, cardiovascular risk, and mortality in older adults. JAMA 2006; 295(9): 1033– 1041. doi: 10.1001/ jama.295.9.1033.
7. Ochs N, Auer R, Bauer DC et al. Metaanalysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Ann Intern Med 2008; 148(11): 832– 845.
8. Völzke H, Schwahn C, Wallaschofski H et al. Review: The association of thyroid dysfunction with all--cause and circulatory mortality: is there a causal relationship? J Clin Endocrinol Metab 2007; 92(7): 2421– 2429.
9. Singh S, Duggal J, Molnar J et al. Impact of subclinical hyroid disorders on coronary heart disease, cardiovascular and all-cause mortality: a meta-analysis. Int J Cardiol 2008; 125(1): 41– 48.
10. Collet TH, Gussekloo J, Bauer DC et al. Thyroid Studies Collaboration: Subclinical hyperthyroidism and the risk of coronary heart disease and mortality. Arch Intern Med 2012; 172: 799– 809. doi: 10.1016/ j.ijcard.2007.02.027.
11. Haentjens P, Van Meerhaeghe A, Poppe K et al. Subclinical thyroid dysfunction and mortality: an estimate of relative and absolute excess all-cause mortality based on time-to-event data from cohort studies. Eur J Endocrinol 2008; 159(3): 329– 341. doi: 10.1530/ EJE-08-0110.
12. Yang LB, Jiang DQ, Qi WB et al. Subclinical hyperthyroidism and the risk of cardiovascular events and all-cause mortality: an updated meta-analysis of cohort studies. Eur J Endocrinol 2012; 167(1): 75– 84. doi: 10.1530/ EJE-12-0015.
13. Selmer C, Olesen JB, Hansen ML et al. Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events: a large population study. J Clin Endocrinol Metab 2014; 99(7): 2372– 2382. doi: 10.1210/ jc.2013-4184.
14. Pearce SH, Brabant G, Duntas LH et al. 2013 ETA Guideline: management of subclinical hypothyroidism. Eur Thyroid J 2013; 2(4): 215– 228. doi: 10.1159/ 000356507.
15. Jonklaas J, Bianco AC, Bauer AJ et al. Guidelines for the treatment of hypothyroidism. Thyroid 2014; 24(12): 1670– 1751. doi: 10.1089/ thy.2014.0028.
16. Batcher EL, Tang XC, Singh BN et al. Thyroid function abnormalities during amiodarone therapy for persistent atrial fibrillation. Am J Med 2007; 120(10): 880– 885.
17. Trip MD, Wiersinga W, Plomp TA. Incidence, predictability, and pathogenesis of amiodarone-induced thyrotoxicosis and hypothyroidism. Am J Med 1991; 91(5): 507– 511.
18. van Beeren HC, Bakker O, Wiersinga WM. Structure-function relationship of the inhibition of the 3,5,3'-triiodothyronine binding to the alpha1- and beta1-thyroid hormone receptor by amiodarone analogs. Endocrinology 1996; 137(7): 2807– 2814.
19. Basaria S, Cooper DS. Amiodarone and the thyroid. Am J Med 2005; 118(7): 706– 714. doi: 10.1016/ j.amjmed.2004.11.028.
20. Eaton SE, Euinton HA, Newman CM et al. Clinical experience of amiodarone-induced thyrotoxicosis over a 3-year period: role of colour-flow Doppler sonography. Clin Endocrinol (Oxf) 2002; 56(1): 33– 38.
21. Piga M, Cocco MC, Serra A et al. The usefulness of 99mTc-sestaMIBI thyroid scan in the differential diagnosis and management of amiodarone-induced thyrotoxicosis. Eur J Endocrinol 2008; 159(4): 423– 429. doi: 10.1530/ EJE-08-0348.
22. Ross DS. Amiodarone and thyroid dysfunction. Up to Date, section editor Cooper DS. http:/ / www.uptodate.com/ contents/ amiodarone-and-thyroid-dysfunction.
23. Bogazzi F, Bartalena L, Tomisti L et al. Continuation of amiodarone delays restoration of euthyroidism in patients with type 2 amiodarone-induced thyrotoxicosis treated with prednisone: a pilot study. J Clin Endocrinol Metab 2011; 96(11): 3374– 3380. doi: 10.1210/ jc.2011-1678.
24. Bogazzi F, Bartalena L, Martino E. Approach to the patient with amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 2010; 95(6): 2529– 2535. doi: 10.1210/ jc.2010-0180.
25. Bartalena L, Bogazzi F, Chiovato L et al. 2018 European Thyroid Association (ETA) Guidelines for the management of amiodarone-associated thyroid dysfunction. Eur Thyroid J 2018; 7(2): 55– 66. doi: 10.1159/ 000486957.
26. Uzan L, Guignat L, Meune C et al. Continuation of amiodarone therapy despite type II amiodarone-induced thyrotoxicosis. Drug Saf 2006; 29(3): 231– 236.
27. Kurnik D, Loebstein R, Farfel Z et al. Complex drug-drug-disease interactions between amiodarone, warfarin, and the thyroid gland. Medicine (Baltimore) 2004; 83(2): 107– 113.
28. Doggrell SA, Hancox JC. Dronedarone: an amiodarone analogue. Expert Opin Investig Drugs 2004; 13(4): 415– 426. doi: 10.1517/ 13543784.13.4.415.
29. Fraczek MM, Łacka K. Thyroid hormone and the cardiovascular system. Pol Merkur Lekarski 2014; 37(219): 170– 174.
30. Límanová Z, Šimonová J. Změny tyreoidáních hormonů u čerstvého srdečního infarktu. Vnitř Lék 1984; 30(12): 1177– 1185.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie KardiologieČlánek vyšel v časopise
Kardiologická revue – Interní medicína

2018 Číslo 3
Nejčtenější v tomto čísle
- Hypertyreóza a srdce
- Perindopril a léčba kardiovaskulárních onemocnění aneb 25 let úspěšného působení perindoprilu v kardiologii
- Podmínky úhrady inhibitorů PCSK9 v ČR – aktuální stav
- Hypotyreóza a srdce
